在常温下发生以下几个反应:①16H++10Z-+2XO4-=2X2+ + 5Z2+8H2O
②2A2+ + 5B2=2A3++2B- ③2B-+ Z2 =B2+2Z-
根据上述反应,判断下列结论错误的是( )
| A.溶液中可发生:Z2+2A2+=2A3++2Z- | B.Z2在①③反应中为氧化剂 |
| C.氧化强弱顺序为:XO4-> Z2> B2> A3+ | D.X2+是XO4-的还原产物 |
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1,
Na2O2(s)+CO2(g)===Na2CO3(s)+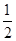 O2(g)ΔH=-226 kJ·mol-1。
O2(g)ΔH=-226 kJ·mol-1。
根据以上热化学方程式判断,下列说法正确的是
| A.CO的燃烧热为283 kJ |
| B.上图可表示由CO生成CO2的反应过程和能量关系 |
| C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1 |
| D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023 |
下列热化学方程式中的ΔH能表示物质燃烧热的是
| A.2CO(g)+O2(g)=2CO2(g) ΔH =" -" 566 KJ·mol-1 |
| B.CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH =" -" 890 KJ·mol-1 |
| C.2H2(g)+O2(g)=2H2O(l)ΔH =" -" 571.6 KJ·mol-1 |
| D.H2(g)+Cl2(g)="2HCl(g)ΔH" =" -" 184.6 KJ·mol-1 |
下列说法正确的是
| A.在101 k Pa时,1 mol C与适量O2反应生成1mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ/mol |
| B.在10l k Pa时,l mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2燃烧热为—285.8KJ/mol |
| C.鉴定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度、NaOH起始温度和反应后终止温度 |
| D.在稀溶液中:,若将0.5mol H2SO4的浓硫酸与含1mol NaOH的溶液混合,放出的热量等于57.3KJ |
在下列各说法中,正确的是
| A.△H >0表示放热反应,△H <0表示吸热反应 |
| B.热化学方程式中的化学计量数只表示物质的量,可以是分数 |
| C.1 molH2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热 |
| D.1 molH2与0.5 mol O2反应放出的热就是H2的燃烧热 |
下列说法中正确的是
| A.有能量变化的过程一定是化学变化过程 |
| B.需要加热才能发生的反应是吸收能量的反应 |
| C.化学反应中一定放出热量 |
| D.物质发生燃烧的反应一定是释放能量的反应 |