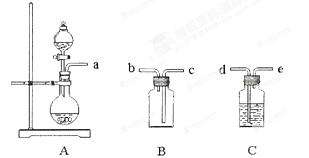
某实验小组同学为了探究铜与浓硫酸的反应,进行如下实验。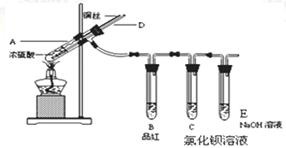
实验1:铜与浓硫酸反应,实验装置如图所示。
实验步骤:
①先连接好装置,检验气密性,加入试剂;②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面;
(1)能够证明铜与浓硫酸反应产生的气体的现象: 。
(2)在盛有氯化钡溶液的C试管中除了导管口有气泡外,无其他明显现象,若将其分为两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应位置。
| 滴加的溶液 |
氯水 |
氨水 |
| 沉淀的化学式 |
__________________________ |
__________________________ |
写出其中SO2显示还原性的离子方程式: 。
(3)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是: 。
(4)将SO2气体通入含有n mol Na2S溶液中,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体 mol。(不考虑溶解的SO2)。
下面是关于药物“华素片(西地碘片)”使用说明书中的部分内容:
华素片(西地碘片)的主要活性成分是分子碘,含量1.5 mg/片,是将碘利用分子分散技术制成分子态西地碘,并加入适量薄荷脑等。
(1)根据上述说明和所学化学知识回答:
①华素片中含有的活性成分是________(写分子式);
②请推断华素片________(“是”或“不是”)白色。
(2)某学生为验证华素片中确定含有上述活性成分,完成实验如下,请填写:
①取一粒药片放入研钵中研碎,将药粉装入试管中,并加入约2 mL蒸馏水;再向该试管中加入约2 mL________(填编号),并用力振荡。
| A.酒精 | B.NaOH溶液 |
| C.四氯化碳 | D.盐酸 |
②描述加入该液体后可能观察到的现象
________________________________________________________________________。
③选用该液体做实验的原因是
________________________________________________________________________。
(3)请再设计另一种方法,验证华素片中的活性成分(注意叙述操作方法和实验结论)________________________________________________________________________
________________________________________________________________________。
在某澄清溶液中,可能存在下述几种离子:H+、K+、Ba2+、SO42—、I—、CO32—。取该溶液进行下述实验:
①用pH试纸检验,该溶液呈强酸性;
②取部分溶液,滴入几滴氯水,再加入少量四氯化碳,振荡后静置,四氯化碳层呈紫色;
③另取部分溶液,逐滴加入NaOH溶液,使溶液由酸性逐渐呈碱性,然后再加入Na2CO3溶液,有白色沉淀生成。
根据上述实验现象,推断原溶液中:
(1)肯定存在的离子是,
(2)肯定不存在的离子是。
(3)可能存在的离子是。
(4)写出步骤②中发生反应的离子方程式。
Ⅰ 某同学为了验证氢气还原氧化铜的反应产物,设计了如下图所示的实验装置。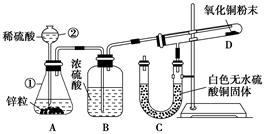
(1)写出编号仪器的名称:①________ ②________。
(2)浓硫酸的作用是____________________________________。
(3)本实验需要加热的装置为________(填字母编号)。
(4)写出装置C、D中可观察到的现象:C________,D________。
(5)D中反应每生成1mol水分子,转移的电子数为________个。
Ⅱ 实验时他需要1.0mol/L的硫酸溶液250mL。根据溶液的配制回答下列问题。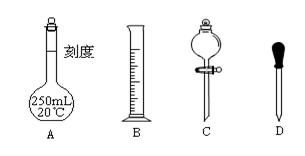
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,配制上述溶液还需要的玻璃仪器是 。
(2)在容量瓶的使用方法中,下列操作不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转几次,摇匀。
(3)根据计算得知,需用量筒量取质量分数为98%、密度为1.84g/cm3的浓硫酸的体积为mL,如果实验室有15mL、20mL、50mL量筒,应选用mL量筒最好。
硫酸工业尾气中二氧化硫的含量超过0.05%(体积分数)时需经处理后才能排放。某校化学兴趣小组欲测定某硫酸工厂排放尾气中二氧化硫的含量,分别采用以下方案:
[甲方案]:如右图所示,图中气体流量计B用于准确测量通过的尾气体积。将尾气通入一定体积已知浓度的碘水中测定SO2的含量。当洗气瓶C中溶液蓝色消失时,立即关闭活塞A。
(1)洗气瓶C中导管末端连接一个多孔球泡D,可以提高实验的准确度,其理由是___________________________________。
(2)洗气瓶C中溶液蓝色消失后,没有及时关闭活塞A,测得的SO2含量_________(填“偏高”、“偏低”或“无影响”)。
[乙方案]:实验步骤如下面流程图所示:
(3)步骤①中过量H2O2的作用是
(4)写出步骤②中反应的化学方程式______________________________________
(5)步骤②中Ba(OH)2是否足量的判断方法是_______________________________
___________________________________________________________________。
(6)通过的尾气体积为V L(已换算成标准状况)时,该尾气中二氧化硫的含量(体积分数)为_____________________________(用含有V、m的代数式表示)。
硫酸工业中废渣的成分为SiO2、Fe2O3、Al2O3、MgO。 某探究性学习小组的同学设计以下实验方案,将硫酸渣中金属元素转化为氢氧化物沉淀分离开来。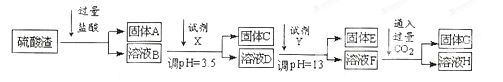
已知常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下: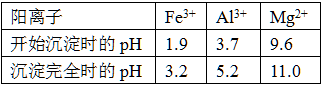
(1)工业上用固体A作原料制取粗硅的化学方程式为。
(2)实验室用11.9mol/L的浓盐酸配制250mL3.0 mol/L的稀盐酸,所用的玻璃仪器除烧杯、玻璃棒和量筒外,还需要。
(3)上述流程中的试剂Y最好选用下列中的(选填字母编号)。
| A.水 | B.氧化镁 | C.氨水 | D.氢氧化钠 |
(4)写出反应F→H的离子方程式。
(5)溶液H显碱性,原因是(用离子方程式和必要的文字说明)。
(6)实验室可用大理石和稀盐酸反应制取上述流程中所需的CO2,仪器如下,装置A产生CO2,按气流方向连接各仪器接口,顺序为a→,装置C中应 盛放的试剂为。