小明在实验室里加热31.6g高锰酸钾制取氧气,完全反应后剩余固体质量为28.4g。将剩余固体溶解、过滤、烘干、称量,回收二氧化锰。请计算:
(1)生成氧气的质量为 g。
(2)回收过程中溶解和过滤均用到玻璃棒,它们的作用分别是 、 。
(3)回收得到二氧化锰的质量。(写出计算过程)
28.7g的氯化钠和硝酸钠的混合物,溶于100g水中,向所得溶液中加入134g的硝酸银溶液,恰好完全反应,得到溶液的质量是234g。计算:原混合物中钠元素的质量分数。(已知:AgNO3 + NaCl =" AgCl↓+" NaNO3;计算结果精确到1%)
将15.8 g高锰酸钾放入试管中加热制取氧气,充分反应至不再产生气体为止。
计算:剩余固体物质的总质量是多少克?(已知:2KMnO4 K2MnO4+MnO2+O2↑)
K2MnO4+MnO2+O2↑)
在一烧杯中盛有42.2g碳酸钙和氯化钙的粉末状混合物,向其中加入116.6g水,使氯化钙完全溶解。然后向其中逐滴加入10%的稀盐酸,烧杯中剩余固体的质量与加入稀盐酸的质量关系曲线如图所示,请根据题意回答问题: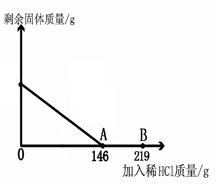
(1)当滴入稀盐酸质量至图中A点时,求所得溶液中溶质的质量分数。
(2)当滴入稀盐酸质量至图中B点时,继续向烧杯中加入上述粉末状混合物至刚刚无气泡产生,求此时烧杯中钙元素质量。
中国科技大学钱逸泰教授等人以四氯化碳(CCl4)和金属钠为原料,在一定的条件下制造出纳米级金刚石粉末。化学方程式为CCl4+4Na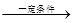 C(金刚石)+4NaCl。这项成果被科学家们评价为“稻草变黄金”。 若要制得1.2g金刚石粉末,求需要金属钠的质量。
C(金刚石)+4NaCl。这项成果被科学家们评价为“稻草变黄金”。 若要制得1.2g金刚石粉末,求需要金属钠的质量。
在完成实验“二氧化碳的制取”后,废液桶中倾倒了含有较多盐酸的混合溶液。为避免酸液污染环境,化学兴趣小组做了如下实验:取废液60g,向其中加入溶质质量分数为21.2%的碳酸钠溶液。所得溶液pH与加入的碳酸钠溶液的质量关系如右图所示:(不考虑CO2溶于水对溶液酸碱性的影响)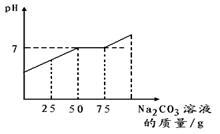
(1)通过右图可知,当碳酸钠溶液质量加到g时,废液中的盐酸恰好处理完。
(2)计算废液中氯化钙的质量分数。