PNA是一种具有良好的热稳定性、耐腐蚀性和抗水性的高分子化合物,常用作塑化剂,其合成路线如下图所示: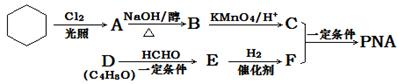
已知:①R1CH=CHR2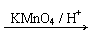 R1COOH + R2COOH (R1、R2代表烃基)
R1COOH + R2COOH (R1、R2代表烃基)
②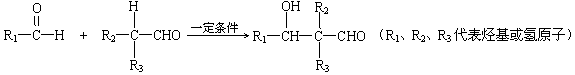
请回答:
(1)E→F的反应类型是 。
(2)C含有的官能团名称是 。
(3)A分子中只有一个氯原子,A→B的化学方程式是 。(注明反应条件)
(4)D能发生银镜反应,且分子中有支链,D的结构简式是 。
(5)E的结构简式是 。
(6)C与F在一定条件下生成增塑剂PNA的反应的化学方程式是: 。(不用注明反应条件)
烃A的相对分子质量为42,B与新制的Cu(OH)2加热至沸腾产生红色沉淀,E可作隐形眼镜材料。下列各物质的转化关系如下图所示:


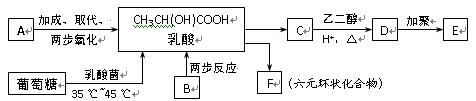
已知: ,请回答下列问题:
,请回答下列问题:
(1)多羟基醛、多羟基酮以及水解能生成它们的有机物都属于糖类,写出乳酸的同分异
构体中,属于糖的一种有机物的结构简式。
(2)写出以下物质的结构简式:A,E,F。
(3)B的名称是,由B合成乳酸的第一步反应属于反应。
(4)由A合成乳酸的第二步反应化学方程式是(自选合适的无机试剂):
;
(5)C转化为D的化学方程式是。
用A~M分别代表一种物质,它们之间的转化关系如下图所示(部分生成物略去)。其中A为紫色晶体,B、H、J均为常见的单质气体,单质E在浓硝酸中钝化。
请回答下列问题: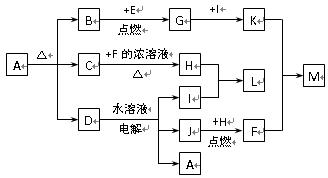
(1)D的化学式是,L由3种元素组成,其电子式是。
(2)E元素在周期表中的位置是。工业上可利用C与E在高温下反应冶炼金属,该反应的化学方程式是。
(3)用C与F溶液制H气体时,发生反应的化学方程式是。
(4)用石墨电极电解D的水溶液时,阳极的电极反应式是。
(5)在500mL0.2mol/LK物质的水溶液中逐滴加入F的水溶液并不断搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随加入F的物质的量的变化曲线。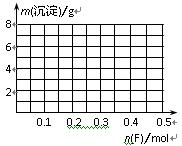
簸箩酯是一种具有菠萝气味的食用香料,是化合物甲与苯氧乙酸 -O-CH2-COOH发生酯化反应的产物。
-O-CH2-COOH发生酯化反应的产物。
(1)甲一定含有的官能团的名称是_________。
(2)5.8g甲完全燃烧可产生0.3molCO2和0.3molH2O,甲蒸气对氢气的相对密度是29,甲
分子中不含甲基,且为链状结构,其结构简式是______________________。
(3)苯氧乙酸有多种类型的同分异构体,其中能与FeCl3溶液发生显色反应,且有2种一硝
基取代物的同分异构体是(写出任意2种的结构简式)___________ _____________。
(4)已知:
簸箩酯的合成线路如下:
①及时X不可选用的是(选填字母)__________。
a.CH3COONa溶液 b.NaOH溶液 c.NaHCO3溶液 d.Na
②丙的结构简式是______________,反应Ⅱ的反应类型是_____________________。
③反应Ⅳ的化学方程式是_________________________________________________。
有机物A的分子结构为,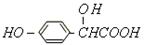 写出A实现下列转变所需的药品
写出A实现下列转变所需的药品
(1)A转变为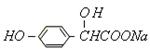 ,
,
(2)A转变为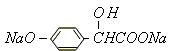 ,
, (3)A转变为
(3)A转变为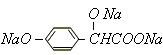 ,
,
短周期元素A、B、C、D。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素的最外层电子数是其电子层数的3倍,D元素原子的M电子层的P轨道中有3个未成对电子
(1)若A为非金属元素,则按原子轨道的重叠方式,A与C形成的化合物中的共价键属于 键(填“σ”或“π”)。
(2)若A元素的原子最外层电子排布为2s1,B元素的原子价电子排布为3s23p2, A、B、C三种元素的单质熔点由大到小的顺序是 (用化学式表示)。
(3)当n=2时,B位于元素周期表的 区,BC2属于 分子(填“极性”或“非极性”)。当n=3时,B与C形成的晶体属于 晶体。