如图所示,用甲醇和氧气以及强碱做电解质溶液的新型燃料电池做电源,对A、B 装置通电一段时间后,发现有1.6g甲醇参加反应且③电极增重(假设工作时无能量损失)。
请回答下列问题:
(1)分别指出F电极、②电极的名称 、 。
(2)④电极的反应式: 。
E电极的反应式: 。
(3)若A池中原混合液的体积为500 mL,CuSO4、K2SO4浓度均为0.1 mol/L,电解过程中A池中共收集到标准状况下的气体 L,①、③电极析出固体物质的量之比 。
用纤维素制取硝酸纤维,是利用纤维素组成中的葡萄糖单元的(1)个(2)基可具有的(3)的性质;用纤维素制取葡萄糖是利用它(4)的性质。
用淀粉为原料制取酒精,若有1 kg含40%淀粉的植物果实,经过反应制得227 g 80%的酒精.淀粉的转化率为________.
将蔗糖溶于水,配成10%的溶液,分装在两个试管中,在第一支试管中加入银氨溶液,在水浴中加热,没有变化,原因是蔗糖分子中(1);在第二支试管中,加入几滴稀H2SO4,再在水浴中加热,加NaOH中和酸后也加入银氨溶液,现象是 (2),原因是(3),稀硫酸的作用是(4) 。
患有糖尿病的人,尿中含有糖分(葡萄糖)较多 ,怎样检验一个病人是否患有糖尿病?
白藜芦醇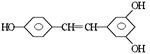 ,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是mol。
,广泛存在于食物(例如桑椹、花生,尤其是葡萄)中。它可能具有抗癌性。该物质和溴水或 氢气反应时,能够跟1 mol 该化合物起反应的Br2或H2的最大用量分别是mol。