被称之为“软电池”的纸质电池总反应为Zn+2MnO2+H2O=ZnO+2MnOOH。下列说法正确的是
| A.该电池中Zn作负极,发生还原反应 |
| B.该电池反应中MnO2起催化作用 |
| C.该电池工作时电流由Zn经导线流向MnO2 |
| D.该电池正极反应式为:MnO2+e-+H2O=MnOOH+OH- |
为了探索外界条件对反应aX(g)+bY(g) cZ(g)的影响,以X和Y的物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是
cZ(g)的影响,以X和Y的物质的量比为a:b开始反应,通过实验得到不同条件下达到平衡时Z的物质的量分数,实验结果如图所示。以下判断正确的是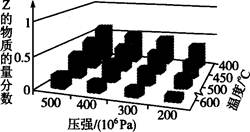
| A.△H>0,a+b>c | B.△H>0,a+b<c |
| C.△H<0,a+b>c | D.△H<0,a+b<c |
下列说法正确的是
| A.石墨比金刚石稳定,故石墨转化为金刚石的反应可以自发进行 |
| B.吸热反应能自发进行的原因是从外界获得了能量 |
| C.SiO2常温下可以与NaOH溶液和HF溶液反应,说明其具有两性 |
| D.反应A(g)+B(g)=2C(s)可以自发进行,则其必为放热反应 |
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表: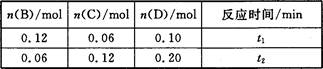
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
下列推断正确的是
| A.由H+(aq)+OH-(aq)=H20(1)△H=-57.3 kJ·mol-1,可知含1 mo1 CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量为57.3 kJ |
| B.由C(石墨)=C(金刚石)△H=+1.9 kJ·mol-1,可知石墨比金刚石更稳定 |
| C.由N2(g)+3H2(g)=2NH3(g)△H=-92.4 kJ·mol-1,可知将1 mol N2(g)和3 mol H2(g)置于密闭容器中充分反应后放出热量为92.4 kJ |
| D.由△G=△H-T△S可知,所有的放热反应都能自发进行 |
下列离子方程式正确的是
A.用氢氧化钠溶液吸收二氧化氮: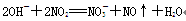 |
B.碳酸氢钠溶液与过量的澄清石灰水反应: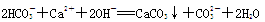 |
C.用浓盐酸酸化的KMnO4溶液与H2O2反应: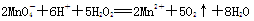 |
D.硫酸氢钠溶液与足量氢氧化钡溶液混合: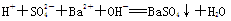 |