煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)在煤的气化反应器中发生如下几种反应:
C(s)十H2O(g)=CO(g)+H2(g) △H1= +131kJ/mol
C(s)+O2(g)=CO2(g) △H2= —394kJ/mol
CO(g)+1/2O2(g)=CO2(g) △H3= —283kJ/mol
则CO(g)+H2O(g) H2(g)+CO2(g)△H=
H2(g)+CO2(g)△H=
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应
CO(g)+H2O(g) H2(g)+CO2(g),得到如下三组数据:
H2(g)+CO2(g),得到如下三组数据:
| 实验组 |
温度/℃ |
起始量/mol |
平衡量/mol |
反应达平衡时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
5 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验l中以 CO2表示的反应速率为 。
②在900℃时,此反应的平衡常数K=
③若其它条件不变向实验2的平衡混合物中再加入0.4 mol H2O和0.4 mol CO2,达到新平衡时CO的转化率将 (变大、变小、不变)
(3)将标准状况下224mLCO2通入200mL 0.1 mol/L KOH溶液中,充分反应后得到溶液X,若不考虑溶液体积的变化,下列有关X的叙述不正确的是
A、c(OH-)=c(H+)+ c(HCO3—)+ 2c(H2CO3)
B、该溶液中,c(K+) > c(CO32—) > c(OH-) > c(HCO3—)> c(H+)
C、该溶液中,水电离出的c(OH-)大于水电离出的c(H+)
(4)以CO和O2为原料,用KOH作电解质组成燃料电池,则该电池负极的反应式为 。
若将该电池作电源,以石墨为电极电解硫酸铜溶液,当产生时0.64gCu,理论上至少需要消耗标况下的CO气体 mL
(10分) 某同学用如图所示装置探究SO2的性质及其有关实验.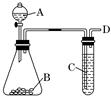
(1)实验室用亚硫酸钠固体和一定浓度的硫酸反应制备SO2气体,写出该反应的化学方程式______________________________________________________________
(2)分别将SO2气体通入下列C溶液中,请回答下列问题:
①少量SO2通入紫色石蕊试液,现象是______________,继续通入过量SO2气体,现象是________________.
②SO2通入紫色KMnO4溶液,现象是______________,其反应的离子方程式为_______________________.
③过量SO2慢慢地通入澄清石灰水中,现象___________________________________
④若C为双氧水,则通入SO2后,请大胆判断所得溶液是________(填溶质的化学式),若该同学制备的SO2气体中混有CO2气体,产生杂质的原因可能是亚硫酸钠固体中混有__________.
某同学用碳棒、纯铜片、直流电源和稀硫酸为原材料,实现了在通常条件下不能发生的反应:Cu + H2SO4(稀) = CuSO4 + H2↑
(1)请在右边方框中画出能够实现这一反应的装置图。
(2)在设计实验实际操作时,由于装置连接不当,他看到了完全不同的实验现象:碳棒和铜片上均有无色气泡产生,溶液并未变为蓝色。请你分析其原因①。
假设按照该方案进行实验,且收集到碳棒上产生气体体积为11. 2L(标准状况下)。则该过程中铜片上发生的反应式为②。此时要使溶液恢复到实验前的状态,需加入③(写出该物质的化学式),其质量为 ④。
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用,引起了各国的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
CH3OH(g)+H2O(g),图1表示该反应进行过程中能量(单位为kJ·mol—1)的变化。
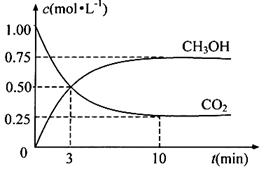
图1图2
(1)写出该反应的热化学方程式。
(2)关于该反应的下列说法中,正确的是。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S<0 D.△H<0,△S>0
(3)该反应的平衡常数K的表达式为:。
(4)温度降低,平衡常数K(填“增大”、 “不变”或“减小”)。
(5)为探究反应原理,现进行如下实验:在体积为1 L的密闭容器中,充入1 molCO2和3 molH2,测得CO2和CH3OH(g)的浓度随时间变化如图2所示。从反应开始到平衡,用氢气浓度变化表示的平均反应速率v (H2)=。
(6)下列措施中能使n(CH3OH)/n(CO2)增大的有。
A.升高温度 B.加入催化剂
C.将H2O(g)从体系中分离 D.充入He(g),使体系总压强增大
实验室有一未知浓度的稀盐酸,某学生为测定盐酸的浓度在实验室中进行如下实验:
Ⅰ.配制100mL 0.10mol/L NaOH标准溶液。
Ⅱ.取20.00mL待测稀盐酸溶液放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的标准NaOH溶液进行滴定。
Ⅲ.重复上述滴定操作2~3次,记录数据如下。
| 实验编号 |
NaOH溶液的浓度 (mol/L) |
滴定完成时,NaOH溶液滴入的体积(mL) |
待测盐酸溶液的体积 (mL) |
| 1 |
0.10 |
22.62 |
20.00 |
| 2 |
0.10 |
22.72 |
20.00 |
| 3 |
0.10 |
22.80 |
20.00 |
(1)滴定达到终点的现象是 ①,此时锥形瓶内溶液的pH范围为②。
(2)根据上述数据,可计算出该盐酸的浓度约为(保留两位有效数字)。
(3)排去碱式滴定管中气泡的方法应采用下图的操作,然后挤压玻璃球使尖嘴部分充满碱液。
甲乙丙
(4)在上述实验中,下列操作(其它操作正确)会造成测定结果偏高的有(多选扣分)。
A.滴定终点读数时俯视读数
B.酸式滴定管使用前,水洗后未用待测盐酸溶液润洗
C.锥形瓶水洗后未干燥
D.配制NaOH标准溶液时,没有等溶解液降至室温就转移至容量瓶中
E.配制NaOH标准溶液时,定容时仰视容量瓶的刻度线
F.碱式滴定管尖嘴部分有气泡,滴定后消失
某造纸厂排出的废水,经取样分析其中除了含有游离汞、纤维素以及其它的有机物外,其它成分为: c(Na+)=4×10-4mol/L,c(SO42-)=2.5×10-4mol/L, c(Cl-)=1.6×10-5 mol/L,c(NO3-)=1.4×10-5 mol/L,c(Ca2+)=1.5×10-5 mol/L,则该废水的pH为__________。