常温下,0.1mol·L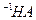 溶液中,
溶液中, =
=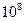 。现取0.1mol·L
。现取0.1mol·L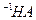 溶液与PH=13的
溶液与PH=13的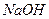 溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
溶液等体积混合(忽略混合后溶液体积的变化)。试回答下列问题:
(1)混合溶液呈_______性(“酸”﹑“中”或“碱”),理由(用离子方程式表示)________.
(2)混合溶液中由水电离出的 ___________0.1mol·L
___________0.1mol·L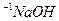 溶液中由水电离出的
溶液中由水电离出的 (填“大于”﹑“小于”或“等于”)。
(填“大于”﹑“小于”或“等于”)。
(3)若混合后溶液的pH=a,则 -
-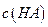 =_________mol·L
=_________mol·L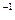 (用含a的代数式表示)。
(用含a的代数式表示)。
化学学习中有很多形如“A+B→C+D”的反应,请根据不同的情况回答下列问题:
(1)如果上式中A、B、C、D均为多核10电子微粒,其中A为阳离子,B为阴离子,C、D均为分子,且C的相对分子质量比D大1。则:
①A+B→C+D表示的离子方程式为。
②标准状况下,若2.24L的D被50mL 1mol/L硫酸吸收,则所得溶液中各离子浓度从大到小的顺序为____。
(2)如果上式中A、C为生活中常见的金属单质,B、D为两种氧化物且它们的摩尔质量比为12:17,其中D能与NaOH溶液反应。则:
①A+B→C+D表示的化学方程式为。
②D与NaOH溶液反应的化学方程式为___。
③若将B溶于盐酸后,再加入足量NaOH溶液可观察到的现象为。
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产、生活中有着重要作用。
(1)根据右侧能量变化示意图,请写出NO2和CO反应的热化学方程式。
(2)在固定体积的密闭容器中,进行如下化学反应:N2(g)+3H2(g) 2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
2NH3(g)△H < 0,其平衡常数K与温度T的关系如下表:
| T/K |
298 |
398 |
498 |
| 平衡常数K |
4.1×106 |
K1 |
K2 |
①该反应的平衡常数表达式:K=
②试判断K1K2(填写“>”,“=”或“<”)
③下列各项能说明该反应已达到平衡状态的是(填字母)
a.容器内N2、H2、NH3的浓度之比为1∶3∶2 b.v(N2)正 = 3v(H2)逆
c.容器内压强保持不变 d.混合气体的密度保持不变
(3)对反应N2O4(g) 2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
2NO2(g)△H > 0 ,在温度分别为T1、T2时,平衡体系中NO2的体积分数随压强变化曲线如右图所示,下列说法正确的是。
a.A、C两点的反应速率:A>C
b.A、C两点的化学平衡常数:A>C
c.A、C两点N2O4的转化率:A>C
d.由状态B到状态A,可以用加热的方法
(4)一定温度下,在1L密闭容器中充入1molN2和3molH2并发生反应。若容器容积恒定,10min达到平衡时,气体的总物质的量为原来的7/8,则N2的转化率a(N2)=,以NH3表示该过程的反应速率v(NH3)= 。
(5)实验室制取氨气的化学反应方程式 .
Ⅰ.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)、聚偏二氯乙烯(PVDC),PE和PVDC是安全的。PVC被广泛地用于食品、蔬菜外包装,它对人体的潜在危害主要来源于两个方面。一是产品中氯乙烯单体残留量(氯乙烯对人体的安全限量标准为小于1 mg/kg),二是加工过程中使用的加工助剂的种类及含量。现行国际标准和我国国家标准都允许限量使用己二酸二辛酯(即DOA)作为增塑剂(不超过35%)。化学工作者和广大消费者十分关注聚氯乙烯(PVC)保鲜膜的安全问题。PVC保鲜膜的安全隐患主要来自于塑料中残留的PVC单体以及不符合国家标准的增塑剂DEHA。
(1)工业上用乙烯和氯气为原料经下列各步反应合成PVC:
乙是PVC的单体,其结构简式为,反应②的反应类型是 ____
(2)邻苯二甲酸二辛酯(DOP)是国家标准中允许使用的增塑剂之一,邻苯二甲酸酐( )是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂 DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为。
)是制造DOP的原料,它跟过量的甲醇反应能得到另一种增塑剂 DMP(分子式为C10H10O4),DMP属于芳香酸酯,其结构简式为。
(3)在适当的条件下,DMP经反应可得到芳香族化合物A(C8H6O4),1mol A与足量的NaHCO3溶液反应可放出CO2气体44.8L(标准状况下),1mol A在一定条件下和1 mol B反应生成 1 mol C和2 mol H2O,C的分子式为C10H8O4,请写出A和B反应的化学方程式___________________。
(4)A的同分异构体有很多,请写出任意一种既属于羧酸又属于酯的芳香族化合物的结构简式::;
Ⅱ.某可降解塑料的单体为D,经测定D的相对分子质量在90~120之间,其中含碳的质量分数为46.2%,含氢的质量分数为7.7%,其余为氧。请回答下列问题:
(1)D的分子式为。
(2)1molD与足量NaHCO3反应得到22.4L(标准状况下)CO2,与足量金属钠反应,得到22.4L(标准状况下)H2。则D分子中含有的官能团的名称为
(3)在一定条件下,D可发生反应生成五元环,则D的结构简式为。
(4)一定条件下D聚合成可降解塑料的化学方程式为。
(1)某次发射火箭,用N2H4(肼)在NO2中燃烧,生成N2、液态H2O。已知:
N2(g)+2O2(g)=2NO2(g)△H1=+68kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(l)△H2=-534kJ/mol
请写出该次发射火箭时燃烧反应的热化学方程式。
(2)下表是不同温度下水的离子积数据:
| 温度/℃ |
25 |
t1 |
t2 |
| 水的离子积常数 |
1×10-14 |
a |
1×10-12 |
若25<t1<t2,则a 1×10-14(填“>”、“<”或“=”);
t2℃下,某Na2SO4溶液中c(SO)=5×10-4 mol·L-1,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)= 。
(3)牙齿表面由一层硬的、组成为Ca5(PO4)3OH的羟基磷灰石保护着,它在唾液中存在平衡:Ca5(PO4)3OH(s) 5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
5Ca2+(aq)+3PO(aq)+OH-(aq);Ksp=2.5×10-59。进食后,细菌和酶作用于食物,产生有机酸,这时牙齿就会受到腐蚀,其原因是 。
已知Ca5(PO4)3F的Ksp=2.8×10-61,比Ca5(PO4)3OH质地更坚固。请写出当牙膏中配有氟化物添加剂后能防止龋齿的原因: 。(用离子方程式表示及简要的文字解释)
(4)一定条件下,某密闭容器中N2O4和NO2的混合气体达到平衡时,c(NO2)=0.50mol/L、c(N2O4)="0.125" mol/L。则2NO2(g) N2O4(g)的平衡常数K=。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为。
N2O4(g)的平衡常数K=。若NO2起始浓度为2 mol/L ,相同条件下,NO2的最大转化率为。
下图中A、B均为固体,其中B为固体单质。下图可用于工业生产液体F,F的消费量常被视为一个国家工业发展水平的标志。回答下列问题:
(1)A由两种元素构成,原子个数比为1:2,D为红棕色固体,A的化学式
(2)写出D与铝单质反应的化学方程式
(3)反应②是可逆反应,在2 L的密闭容器中投入4 molC和3 molX,10分钟后反应达到平衡,平衡时混合气体共6 mol,则下列说法正确的是
A.这10分钟内,X的平均速率是0. 1mol/( L·min)
B. 在工业生产中可以通过增加X的量来提高C的转化率
C.当C和X的消耗速率比为2:1时,标志着反应达到平衡
D.平衡时C的转化率是50%
(4)写出标准状况下2.24L气体C与0.15mol氢氧化钠溶液反应的离子方程式