(12分)A、B、C、D、E、F为原子序数依次增大的短周期主族元素。A、F原子的最外层电子数均等于其周期序数,F原子的电子层数是A的3倍;B原子核外电子分处3个不同能级且每个能级上的电子数相同;A与C形成的分子为三角锥形;D原子p轨道上成对电子数等于未成对电子数;E原子核外每个原子轨道上的电子都已成对,E电负性小于F。
(1)写出B的基态原子的核外电子排布式: 。
(2)A、C形成的分子极易溶于水,其主要原因是 。与该分子互为等电子体的阳离子为 。
(3)比较E、F的第一电离能:E F。(选填“>”或“<”)
(4)BD2在高温高压下所形成的晶胞如图所示 。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。
。该晶体的类型属于 (选填“分子”、“原子”、“离子”或“金属”)晶体,该晶体中B原子的杂化形式为 。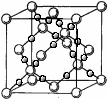
(5)光谱证实单质F与强碱性溶液反应有[F(OH)4]-生成,则[F(OH)4]-中存在 。(填序号)
a.共价键
b.非极性键
c.配位键
d.σ键
e.π键
室温下,(1)pH=5和pH=3的两种盐酸以1:1体积比混合,该混合液的pH=;
(2)将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液中 的pH=;
的pH=;
(3)将0.1mol/L的盐酸和0.06mol/L的氢氧化钡以等体积混合后,溶液的pH=;
(4)用0.01mol/LNaOH溶液滴定0.02mol/L 的硫酸,中和后加蒸馏水稀释到5mL,若滴定时终点判断有误差;①多加了1滴NaOH溶液②少加1滴NaOH溶液(设1滴为0.05mL),则①和②溶液中c(OH-)之比是。
(5)0.1mol/L的NaHCO3溶液的pH为8,同浓度的NaAlO2溶液的pH为11。将两种溶液等体积混合,可能发生的现象是______,其主要原因是(用离子方程式表示)______。
(6)设某pH的硫酸中水电离 出的c(H+)=1.0×10-amol/L,设相同的pH的硫酸
出的c(H+)=1.0×10-amol/L,设相同的pH的硫酸 铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正整数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。、。
铝中水电离出的c(H+)=1.0×10-bmol/L(a、b都是小于14的正整数),那么a和b之间应满足的数量关系是(用一个等式和一个不等式表示)。、。
PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度小,另一种为黄绿色,在水中的溶解度较大,请回答下列问题:
⑴PtCl2(NH3)2是平面正方形结构,还是四面体结构
⑵请在以下空格内画出这两种固体分子的几何构型图,淡黄色固体:,黄绿色固体:
⑶淡黄色固体物质是由分子组成,黄绿色固体 物质是由分子组成(填“极性分子”或“非极性分子”)
物质是由分子组成(填“极性分子”或“非极性分子”)
⑷黄绿色固体在水中溶解度比淡黄色固体大,原因是 。
。
下图是元素周期表中短周期元素的一部分,表中所列字母分别代表一种元素: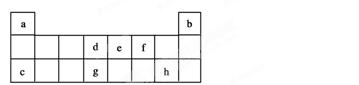
(1)上述元素的单 质中熔点最高的可能是________(填字母)。
质中熔点最高的可能是________(填字母)。
(2)在一定条件下,a与e可形成一种简单化合物,其晶体类型为________,空间结构是________;a与d形成的简单化合物中含________键。(填“极性”或“非极性”)
(3)现有另一种元素X,其原子获得一个电子时所释放出的能量比表中所列元素中都要大,则X是________元素,属于周期表中________族元素。
(4)NH3·H2O的电离方程式为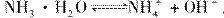 试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。
试判断NH3溶于水后,形成的NH3·H2O的合理结构是________(填序号)。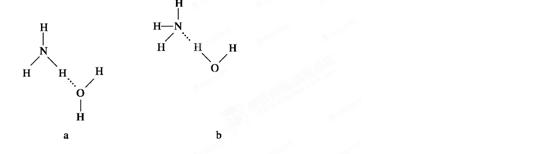
已知镁在空气中燃烧主要生成氧化镁,同时还会与氮气反应生成微量的氮化镁(Mg3N2)在周期表中,镁与锂;铍与铝处于对角线上,处于对角线 上的主族元素性质相似,这称为对角线规则。据此请回答:
上的主族元素性质相似,这称为对角线规则。据此请回答:
(1) 锂在空气中燃烧主要产物的电子式是 _______同时生成微量的____________。(写化学式)
(2)铍的最高价氧化物对应的水化物的化学式是_________________,它属两性化合物,
证明这一结论的有关离子方程式为_______________________,________________________。
(3)若已知反应Be2C+4H2O===2Be(OH)2+CH4↑,则Al4C3遇强碱溶液反应的离子方程式
为________________________________________________。
(4) 用电子式表示BeCl2的形成过程:________________________________________。
(12分)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。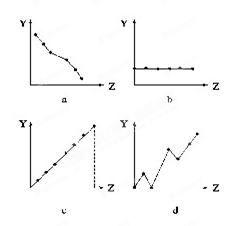
把与下面 元素有关的性质相符的曲线标号填入相应的空格中:
元素有关的性质相符的曲线标号填入相应的空格中:
(1)ⅡA族元素的价电子数____________。
(2)第三周期元素的最高化合价__________。
(3)F-、Na+、Mg2+、Al3+的离子半径________。
(4) 第三周期元素的电负性____________。