下表是实验室制备气体的有关内容:
| 编号 |
实验内容 |
实验原理 |
气体发生装置 |
| ① |
制备氧气 |
H2O2→O2 |
|
| ② |
制备氨气 |
NH4Cl→NH3 |
|
| ③ |
制备氯气 |
HCl→Cl2 |
|
(1)从上述气体制备原理中:从制备过程看,必须选择合适的氧化剂才能实现的是 (填气体的化学式,下同);从反应原理看,明显不同于其他两种气体的是 。
(2)根据表中所列实验原理,从下列装置中选择合适的气体发生装置,将其编号填入上表中的空格中。
(3)某学习小组设计了如下图实验,将氯气依次通过下列装置以验证氯气的性质: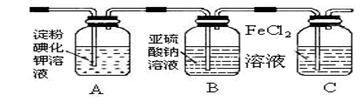
①通入氯气后,A中的现象是 ,
整套实验装置存在的明显缺陷是 。
②C装置中发生反应的离子方程式为: 。
(2013)氧化镁在医药、建筑等行业应用广泛.硫酸镁还原热解制备高纯氧化镁是一种新的探索.以菱镁矿(主要成分为MgCO3,含少量FeCO3)为原料制备高纯氧化镁的实验流程如下:
(1)MgCO3与稀硫酸反应的离子方程式为 .
(2)加入H2O2氧化时,发生反应的化学方程式为 .
(3)滤渣2 的成分是 (填化学式).
(4)煅烧过程存在以下反应:
2MgSO4+C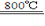 2MgO+2SO2↑+CO2↑
2MgO+2SO2↑+CO2↑
MgSO4+C  MgO+SO2↑+CO↑
MgO+SO2↑+CO↑
MgSO4+3C  MgO+S↑+3CO↑
MgO+S↑+3CO↑
利用如图装置对煅烧产生的气体进行分步吸收或收集.
①D中收集的气体可以是 (填化学式).
②B中盛放的溶液可以是 (填字母).
a.NaOH 溶液 b.Na2CO3溶液c.稀硝酸d.KMnO4溶液
③A中得到的淡黄色固体与热的NaOH溶液反应,产物中元素最高价态为+4,写出该反应的离子方程式: .
利用钛白工业的副产品FeSO4(含TiO2+、Al3+)可以生产电池级高纯超微细草酸亚铁。其工艺流程如下:
(1)检验FeSO4是否已有部分氧化的方法是 。
(2)已知过滤1得到的滤渣的主要成分是Al(OH)3、H2TiO3。请补充化学方程式:
TiOSO4 + =H2SO4 + H2TiO3↓;
铁粉的作用有:①除去溶液中的Fe3+,② 。
(3)沉淀反应的离子方程式是 。
(4)沉淀过程的反应温度为40℃,温度不宜过高的原因除了控制沉淀的粒径外,还有 。FeC2O4生成后,为提高产品纯度,还需调节溶液pH=2,若pH过低,则导致FeC2O4的产率______(填“偏高”、“偏低”或“无影响”)。
(5)过滤2得到的滤液经蒸发浓缩、 、洗涤可得到副产品,该物质可作用于 (写出一种用途)。
乙酰水杨酸俗称阿司匹林,是一种历史悠久的解热镇痛热。合成原理是
(1)水杨酸中含氧官能团的名称是 ,有关水杨酸的说法,正确的是 。
| A.遇FeCl3溶液可能显紫色 |
| B.可发生酯化反应和水解反应 |
| C.能与溴水发生取代反应和加成反应 |
| D.1mol水杨酸最多能与3molH2发生加成反应 |
(2)水杨酸与乙酸酐反应的反应类型是 。
(3)乙酰水杨酸的分子式为 ,1mol乙酰水杨酸最多能与 molNaOH反应。
(4)虚框中为提纯,是为了除去该反应的副产物:水杨酸、乙酰水杨酸水杨酯、乙酰水杨酸酐和聚合物等请写出乙酰水杨酸粗品中加入饱和Na2CO3溶液发生的主要化学反应方程式为:_____ 。
(5)写出一种符合下列条件的乙酰水杨酸的同分异构体的结构简式: 。
Ⅰ.能遇FeCl3溶液显紫色
Ⅱ.苯环上只有一种一溴取代物
Ⅲ.能发生银镜反应
Ⅳ.1mol该化合物能分别与1molNaOH和2mol金属钠反应
(6)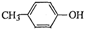 也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
也能与乙酸酐发生类似反应,请写出化学反应方程式,可不写条件:
。
(2013)化合物Ⅰ(C11H12O3)是制备液晶材料的中间体之一,其分子中含有醛基和酯基。Ⅰ可以用E和H在一定条件下合成: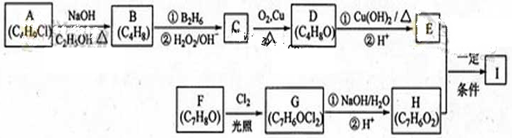
已知以下信息:①A的核磁共振氢谱表明其只有一种化学环境的氢;
②RCH=CH2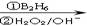 RCH2CH2OH
RCH2CH2OH
③化合物F苯环上的一氯代物只有两种;④通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基。
回答下列问题:
(1)A的化学名称为_________。(2)D的结构简式为_________ 。
(3)E的分子式为___________。
(4)F生成G的化学方程式为 ,
该反应类型为__________。
(5)I的结构简式为___________。
(6)I的同系物J比I相对分子质量小14,J的同分异构体中能同时满足如下条件:
①苯环上只有两个取代基,②既能发生银镜反应,又能和饱和NaHCO3溶液反应放出CO2,共有______种(不考虑立体异构)。J的一个同分异构体发生银镜反应并酸化后核磁共振氢谱为三组峰,且峰面积比为2:2:1,写出J的这种同分异构体的结构简式______ 。
芳香化合物A(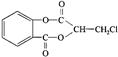 )在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。
)在一定条件下可以发生如下图所示的转化(其他产物和水已略去)。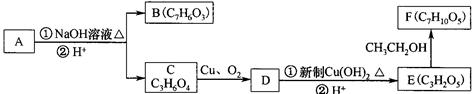
请回答下列问题:
(1)写出A的分子式 。
(2)1 molA在氢氧化钠溶液中加热,充分反应消耗氢氧化钠 mol 。
(3)写出由E制得F的化学方程式: , 反应类型是 。
(4)有机物B与乙酸酐(CH3COOCOCH3)直接反应可制得阿司匹林: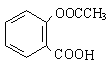
(即乙酰水杨酸,分子式 C9H8O4),满足以下条件的阿司匹林的同分异构体有 种。①苯环上只含有两个侧链
②有两个酯基
③能发生银镜反应
其中核磁共振氢谱是3:2:2:1的结构简式有 种。
(5)有机物C可以由乳酸(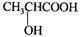 )经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
)经过几步有机反应制得,试写出以乳酸为主要原料制备有机物C的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
CH3CH2OH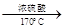 CH2=CH2
CH2=CH2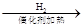 CH2CH3CH3
CH2CH3CH3