下列说法正确的是
| A.常温下向饱和AgCl水溶液中加入盐酸,Ksp值变大 |
| B.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小 |
| C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大 |
| D.物质的溶解度随温度的升高而增加,物质的溶解都是吸热的 |
下列物质中,受热后不易分解的是( )
| A.碳酸氢钠 | B.氯化铵 | C.碱式碳酸铜 | D.硫酸钾 |
下列物质中不会因见光而分解的是()
| A.NaHCO3 | B.HNO3 | C.AgI | D.HClO |
下列指定微粒的个数比为2∶1的是()
| A.Be2+离子中的质子和电子 |
B.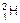 原子中的中子和质子 原子中的中子和质子 |
| C.NaHCO3晶体中的阳离子和阴离子 |
| D.CO气体中分子和原子 |
选择萃取剂将碘水中的 碘萃取出来,这种萃取剂应具备的性质是()
碘萃取出来,这种萃取剂应具备的性质是()
| A.不溶于水,且必须易与碘发生化学反应 | B.不溶于水,且比水更易溶解碘 |
| C.不溶于水,且必须比水密度大 | D.不溶于水,且必须比水密度小 |
下列产品的使用不会对环境造成污染的是( )
| A.含磷洗衣粉 | B.酒精 | C.氟里昂 | D.含汞电池 |