(本题共12分)磷单质及其化合物在工业生产中有着广泛的应用。白磷可用于制备高纯度的磷酸(磷酸结构式为 ),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
),次磷酸钠(NaH2PO2)可用于化学镀镍等等。
完成下列填空:
23.NaH2PO2中涉及到四种元素,它们的原子半径由小到大的顺序为____________。
24.写出与磷同周期的主族元素中,离子半径最小的元素,其最高价氧化物对应水化物的电离方程式______。
25.磷酸二氢钠主要用于制革、处理锅炉水及在食品工业、发酵工业中作缓冲剂。其水溶液呈酸性的原因是_______________________________________________________。(请用文字描述)
26.已知磷酸分子中的三个氢原子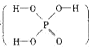 都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是
都可以跟重水分子(D2O)中的D原子发生氢交换。 又知次磷酸(H3PO2)也可跟D2O进行氢交换,但次磷酸钠(NaH2PO2)却不能跟D2O发生氢交换。由此可推断出H3PO2的分子结构是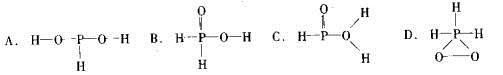
27.次磷酸钠(NaH2PO2)可用于化学镀镍。化学镀镍的溶液中含有Ni2+和H2PO2-,在一定条件下能发生如下反应:__Ni2++__H2PO2-+ →__Ni + ___H2PO3-+_____。请完成并配平上述反应离子方程式。该反应的还原产物是__________,反应中转移1摩尔电子时,理论上产生金属镍______克。
下列有关有机化学实验的叙述正确的是。(填序号)
①向电石中滴加饱和食盐水制取乙炔气体。
②1-氯丁烷在NaOH水溶液中,可以发生消去反应生成1-丁烯
③可向皂化反应后的混合液中,加入饱和食盐水,使肥皂析出
④酒精与浓H2SO4的混合物,加热到140℃可以制取乙烯
⑤向淀粉溶液中加入少量稀硫酸,加热使淀粉水解,再加入银氨溶液,加热,检验淀粉是否发生水解
环己烷可制备1,4-环己二醇,下列七步有关反应(其中无机产物都已经略去)中,其中有两步属于取代反应,两步属于消去反应,三步属于加成反应,试回答:
(1)写出下列化合物的结构简式:
B:C:
(2)反应④所用的试剂和条件分别为:
(3)写出①、④的化学方程式:
①:;④:
(6分)(1)某反应过程中的能量变化如下图所示: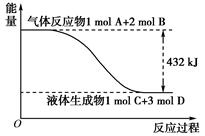
写出该反应的热化学方程式_____________________________________________。
(2)在溶液中进行的化学反应的物质,其状态标为“aq”,已知含0.2 mol HCl的溶液与足量氢氧化钠溶液反应放出11.46 kJ的热量,用离子方程式写出中和热的热化学方程式____________________________________________________________________。
(12分)实验测得,某有机物相对分子质量为72。
(1)若该有机物是烃,其分子式为_________,它有______种同分异构体。若该烃与Cl2发生取代反应,生成的一氯代物只有1种,则该烃的结构简式为_____________。
(2)若该有机物3.6g完全燃烧生成0.15molCO2和0.1molH2O,则该有机物的分子式为_______。若它是一种不饱和羧酸,该酸与甲醇发生酯化反应的化学方程式为(注明反应条件):________,
若它是一种不饱和酯,该酯发生加聚反应的生成物的结构简式为_______________。
请设计一个方案,证明苯酚、碳酸、乙酸的酸性依次增强(所需的试剂自选,只用两个化学方程式表示即可)。
;。