坐落在沿海地区的某纯碱厂是我国重点大型企业,其生产工艺流程可简要表示如图所示:
34.上述生产纯碱的方法称________________;副产品的一种用途为_______________。
35.使原料氯化钠的利用率从70%提高到90%以上,主要是设计了__________(填上述流程中的编号)的循环。从沉淀池中取出沉淀的操作所需玻璃仪器有烧杯、_______________________等。
36.母液中含有NaCl、NH4Cl、_____________________(以化学式表示)。向母液中通入氨气,加入细小食盐颗粒,冷却析出副产品,通氨气的作用有___________
硫酸铜晶体(CuSO4·xH2O),采用加热法测定该晶体中结晶水x的值,实验数据记录如下:
| 坩埚质量 |
坩埚与晶体总质量 |
加热后坩埚与固体总质量 |
||
| 第一次称量 |
第二次称量 |
|||
| 11.710g |
22.700g |
18.621g |
a |
|
37.若无需再进行第三次称量,则a的数值范围应为 。
38.若加热后坩埚与固体总质量为18.620g,计算x 的实测值 (保留二位小数),相对误差 。
(1)以铜电极电解NaOH溶液,若产生1molH2,则消耗H2Omol。
(2)以铂电极电解饱和Na2CO3溶液,一段时间后溶液的浓度(增大、减小或不变),有无晶体析出?(有、无)。
(1)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9kJ·mol-1,H-H键的键能是436.0kJ·mol-1;由N2和H2合成1molNH3时可放出46.2kJ的热量。N-H键的键能是。
(2)盖斯定律在生产和科学研究中有很重要的意义。有些反应的反应热虽然无法直接测得,但可通过间接的方法测定。现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g)△H=-24.8kJ·mol-1
3Fe2O3(s)+ CO(g)==2Fe3O4(s)+ CO2(g)△H=-47.2kJ·mol-1
Fe3O4(s)+CO(g)==3FeO(s)+CO2(g)△H=+640.5kJ·mol-1
写出CO气体还原FeO固体得到Fe 固体和CO2气体的热化学反应方程式:
_________________。
830K时,在密闭容器中发生下列可逆反应:CO(g)+H2O(g)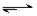 CO2(g)+H2(g)△H<0试回答下列问题:
CO2(g)+H2(g)△H<0试回答下列问题:
(1)若起始时c(CO)=2mol·L-1,c(H2O)=3mol·L-1,达到平衡时CO的转化率为60%,则在该温度下,该反应的平衡常数K=。
(2)在相同温度下,若起始时c(CO)=1mol·L-1,c(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态(填“是”与“否”),此时v(正)v(逆)(填“大于”“小于”或“等于”),你判断的依据是。
(3)若降低温度,该反应的K值将,该反应的化学反应速率将(均填“增大”“减小”或“不变”)。
铅蓄电池是典型的可充型电池,它的正负极格板是惰性材料,电池总反应式为:Pb+PbO2+4H++2SO42-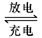 2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)
2PbSO4+2H2O回答下列问题(不考虑氢、氧的氧化还原)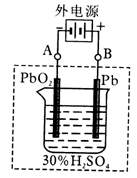
(1)放电时:正极的电极反应式是,电解液中H2SO4的浓度将变________,当外电路通过1mol电子时,理论上负极板的质量增加g。
(2)在完全放电耗尽PbO2和Pb时,若按上图连接,电解一段时间后,则在A电极上生成__________,B电极上生成________,此时铅蓄电池的正负极的极性将____________。
如图为以惰性电极进行电解: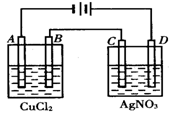
(1)写出B、C、D各电极上的电极反应式和总反应方程式:
A:________________________________,B:________________________________,
总反应方程式:________________________。
C:________________________________, D:________________________________,
总反应方程式:___________________________。
(2)在A、B、C、D各电极上析出生成物的物质的量比为__________________。