(8分)亚硝酸(HNO2)是一种比醋酸略强的弱酸,很不稳定,易发生自身氧化还原反应而分解。
(1)低温下,将等物质的量的NO和NO2通入水中,可制得HNO2,反应的化学方程式为__________________________________________________________.
(2)NO既有氧化性又有还原性,其氧化产物或还原产物与溶液的pH的关系如下表所示:
| pH范围 |
大于7 |
小于7 |
| 产物 |
NO |
NO、N2O、N2中的一种 |
①在碱性条件下,NaNO2溶液与NaClO溶液反应的离子方程式为
_________________________________________________________.
②若HNO2与氢碘酸反应时按物质的量之比1∶2进行,且I-被氧化成I2,则产物中含氮的物质为__________(填化学式).
(3)在冷冻的NaNO2溶液中加入或通入下列物质,不能制得HNO2的是________(填序号).
a.稀H2SO4 b.稀HCl c.CO2 d.SO2
铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下: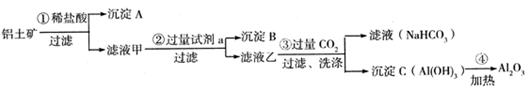
(1)沉淀 A、B的成分分别是、;
(2)步骤②中的试剂a是;
(3)试写出步骤③中发生反应的离子方式;
(4)准确称取6g铝土矿样品,加入100mL盐酸溶液,充分反应后向滤液中加入10 mol·L-1试剂a的溶液,产生沉淀的质量与加入试剂a的体积关系如下图所示,则所用盐酸溶液的物质的量浓度为,样品中Al2O3的百分含量为。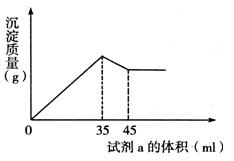
硼酸(H3BO3)在食品、医药领域应用广泛。
(1)请完成B2H6气体与水反应的化学方程式:B2H6 + 6H2O=2H3BO3 +________。
(2)在其他条件相同时,反应H3BO3 +3CH3OH B(OCH3)3 +3H2O中,H3BO 3的转化率(α/﹪)在不同温度下随反应时间(t)的变化见右图,由此图可得出:
B(OCH3)3 +3H2O中,H3BO 3的转化率(α/﹪)在不同温度下随反应时间(t)的变化见右图,由此图可得出:
①温度对应该反应的反应速率和平衡移动的影响是___
②该反应的⊿H_____0(填“<”、“=”或“>”).
(3)H3BO 3溶液中存在如下反应:
H3BO 3(aq)+H2O(l) [B(OH)4]-(aq)+H+(aq);已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,
[B(OH)4]-(aq)+H+(aq);已知0.70 mol·L-1 H3BO 3溶液中,上述反应于298K达到平衡时,
c平衡(H+)="2." 0 × 10-5mol·L-1,c平衡(H3BO 3)≈c起始(H3BO 3),水的电离可忽略不计,求此温度下该反应的平衡常数K(H2O的平衡浓度不列入K的表达式中,计算结果保留两位有效数字)
据报道,一种名为苹果醋(ACV)的浓缩饮料 风靡美国。苹果醋是由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸是这种饮料中的主要酸性物质。已知:在下列有关苹果酸(A)的转化关系中,B能使溴的四氯化碳溶液褪色。
风靡美国。苹果醋是由苹果发酵而成的酸性饮品,具有解毒、降脂、减肥和止泻等功效。苹果酸是这种饮料中的主要酸性物质。已知:在下列有关苹果酸(A)的转化关系中,B能使溴的四氯化碳溶液褪色。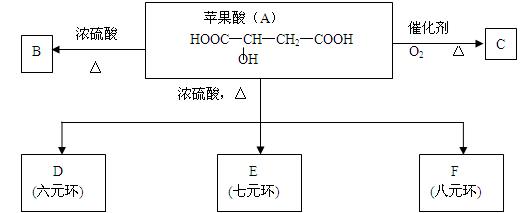
回答下列问题:
(1)苹果酸分子中所含官能团的名称是。
(2)苹果酸不能发生反应的有(选填序号);
①加成反应 ②酯化反应 ③加聚反应 ④氧化反应 ⑤消去反应 ⑥取代反应
(3)写出B、C的结构简式:
B: ;
C: 。
(4)写出A→D的化学方程式:
。
(5)苹果酸(A)有多种同分异构体,写出所有符合下列条件的同分异构体的结构简式:
①能发生银镜反应;②能与苯甲酸发生酯化反应;③能与乙醇发生酯化反应;④1mol该同分异构体可与足量的钠反应放出1.5mol氢气(分子中同一碳原子不能连有2个羟基)。
某混合物A,含有Al2(SO4)3、Al2O3和Fe2O3,在一定条件下可实现下图
所示的变化。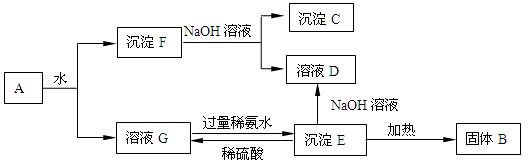
请回答下列问题。
(1)图中涉及分离溶液与沉淀的方法是。
(2)B、C、D、E 4种物质的化学式为:
B、C、D、E。
(3)沉淀F与NaOH溶液反应的离子方程式为。
沉淀E与稀硫酸反应的离子方程式为。
溶液G与过量稀氨水反应的化学方程式为。
有A、、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,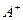 比
比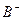 少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数。R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1。请回答下列问题:
(1)A单质、B单质、化合物R的熔点大小顺序为下列的(填序号)。
①单质>B单质>R②R>A单质>B单质
③单质>R>A单质④A单质>R>B单质
(2)在CB3分子中C元素原子的原子轨道发生的是________杂化,其固体时的晶体类型为。
(3)写出D原子的核外电子排布式_,C的氢化物比D的氢化物在水中溶解度大得多的可能原因。
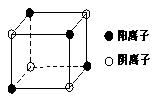
(4)下图是D和Fe形成的晶体FeD2最小单元“晶胞”,FeD2晶体中阴、阳离子数之比为,FeD2物质中具有的化学键类型为。