(本题共14分)自然界中,金属硫化物矿床常因发生表生氧化及次生富集作用,产生辉铜矿(Cu2S)与铜蓝(CuS)。
已知:Cu2S、CuS是两种不溶于水的黑色固体,在一定条件下都能与稀HNO3反应:
①3CuS+8H++8NO3-→3Cu2++3SO42-+8NO↑+4H2O
②3Cu2S+16H++10NO3-→6Cu2++3SO42-+10NO↑+8H2O
现将四份质量不同的某Cu2S和CuS混合物样品分别与100mL 5mol/L的稀硝酸充分反应,样品质量与产生气体的体积(已折合成标准状况)如下表所示:
| 实验编号 |
甲 |
乙 |
丙 |
| 样品质量(g) |
9.6 |
12.8 |
64.0 |
| 气体体积(L) |
5.04 |
6.72 |
V |
试回答下列问题(不考虑硝酸的挥发以及溶液体积变化):
53.用质量分数为0.63、密度为1.42g/cm3的浓硝酸配置100mL、5mol/L的稀硝酸,需浓硝酸的体积为 。(保留1位小数)
54.甲实验结束后,溶液中c(NO3-) = 。
55.混合物样品中Cu2S、CuS的物质的量之比是多少?(写出计算过程)
56.乙实验结束后,溶液中氢离子的浓度是多少?(写出计算过程)
57.计算丙实验中产生气体的体积(V)。(写出计算过程)
在合成氨反应中,入口气体中N2 、H2、NH3的体积比为6∶18∶1,出口气体中N2 、H2、NH3的体积比为9∶27∶8,求H2的转化率。
在密闭容器中,将0.020 mol·L-1CO和H2O(g)混合加热到773K时,达到下列平衡CO(g)+H2O(g)  CO2(g)+H2(g),已知该反应的KC=9,求CO的平衡浓度和转化率。
CO2(g)+H2(g),已知该反应的KC=9,求CO的平衡浓度和转化率。
丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2→CH3COCH2I+H++I-。
25℃时,该反应的速率由下列经验式决定:V=2.73×10-5c(CH3COCH3)c(H+)mol/(L· s)
25℃时,如果c(I2).c(CH3COCH3).c(H+)的起始浓度依次是0.01mol/L,0.1mol/L,
0.01mol/L。求:(1)反应开始时的速率是多少?
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
将等物质的量的A.B混合于2L的密闭容器中,发生下列反应3A(g)+B(g)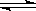 xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
xC(g)+2D(g),经反应5min后,测知D的浓度为0.5mol/L,A.B的物质的量浓度之比为3∶5,C的平均反应速率是0.1mol/(L·min),试计算:
(1)x的值?
(2)5min内B的平均反应速率?
(3)5min时A的物质的量浓度?
高温时空气中的N2和O2会反应生成NO而污染大气:N2(g)+O2(g)==NO(g)。式通过计算说明在1200℃的条件下,此反应能否正向自发进行?估算自发进行的最低温度是多少?(已知:△H="180.50" kJ·mol-1 ,△S=247.7J·mol-1 ·K-1 )