下表数据是对应物质的熔点,下列说法错误的是
| 编号 |
① |
② |
③ |
④ |
| 物质 |
AlF3 |
AlCl3 |
BCl3 |
NCl3 |
| 熔点/℃ |
1291 |
160 |
-107 |
-40 |
A.BCl3、NCl3分子中各原子最外层都满足8电子稳定结构
B.因为键长B-F< B-Cl,故BF3的熔点高于BCl3
C.AlF3、AlCl3都是强电解质,但晶体类型不同
D.BCl3为平面正三角形分子,故它是由极性键构成的非极性分子
下列各组物质,前者属于电解质,后者属于非电解质的是
| A.NaCl晶体、BaSO4 | B.铜、二氧化硫 |
| C.液态的醋酸、酒精 | D.熔融的KNO3、硫酸溶液 |
向一定量的Fe、FeO和Fe2O3的混合物中加入100ml 2mol/L的盐酸,恰好使混合物完全溶解,放出44.8 ml标准状况下的气体,所得溶液中,加入溶液无红色出现,那么若用一氧化碳在高温下还原相同质量的此混合物,能得到铁的质量
| A.5.6g | B.2.8 g | C.11.2g | D.无法计算 |
羟胺(NH2OH)是一种还原剂,能将某些氧化剂还原。现用25.00mL 0.04mol/L的羟胺的酸性溶液跟30.00mL 0.02 mol/L的KMnO4酸性溶液完全作用。已知MnO4- →Mn2+则在上述反应中,羟胺的氧化产物是
| A.NO | B.N2O | C.N2 | D.NO2 |
列实验与对应示意图的关系正确的是
| A |
B |
C |
D |
| NaAlO2溶液中逐滴滴加盐酸至过量 |
AlCl3溶液中逐滴滴加氨水至过量 |
明矾[KAl(SO4)2·12H2O]溶液中逐滴滴加Ba(OH)2溶液至过量 |
澄清石灰水中缓慢通入CO2至过量 |
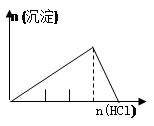 |
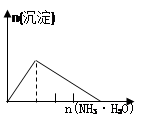 |
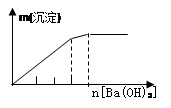 |
 |
向含FeCl3、FeCl2、AlCl3、NaCl的溶液中,加入足量的Na2O2固体后,再加入过量的稀盐酸,溶液中离子数目不发生变化的是
| A.Na+ | B.Al3+ | C.Fe3+ | D.Fe2+ |