(本题共8分)炔烃与羰基化合物在强碱性条件下于乙醚中发生反应,可得到炔醇,反应原理为:
以下合成路线是某化工厂生产流程的一部分:
已知: 
请回答下列问题:
43.写出C中含氧官能团的名称 。
44.有关C的说法正确的是
a.不能使酸性高锰酸钾褪色 b.能和氢氧化钠溶液反应
c.能使溴的四氯化碳溶液褪色 d.能与乙酸发生酯化反应
45.经测定,E的分子结构与天然橡胶结构相同,写出D的名称(系统命名) 。
46.⑤的反应类型是 ;B的结构简式是 。
47.写出反应⑦的化学方程式 。
(1)卤代烃的用途十分广泛。卤代烃(填“能”或“不能”)跟硝酸银溶液反应生成卤化银沉淀。分子式为C3H7Br的卤代烃,其结构简式有两种,分别为
和,它们与NaOH醇溶液反应生成的有机物的结构简式为。为了检验这 种有机物,可把它通入盛有的试管中。
种有机物,可把它通入盛有的试管中。
(2)分子式为C4H10O,属于醇的同分异构体有种,其中一种不能氧化成醛或酮,它的结构简式是;另一种没有支链且能被氧化成醛,写出它与乙酸发生酯化反应的方程式。
命名下列物质或根据题意写出结构简式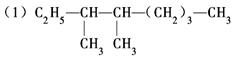 的系统命名法名称是。
的系统命名法名称是。
⑵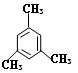 的名称是。
的名称是。
(3) 2-甲基-1-丁烯的结构简式 ,
,
(4) 相对分子质量为72且沸点最低的烷烃的结构简式。
(1)在9.5g某二价金属的氯化物中含0.2mol Cl—,此氯化物的摩尔质量为;该金属元素的相对原子质量为。
(2) 已知N2、CO2的混合气体的质量共10.0克,标准状况下,体积为6.72L,原混合气体中N2、CO2的体积之比.
(1)写出下列化学反应的离子方程式
①氢氧化钡溶液和硫酸铜溶液的反应
②碳酸钠和足量稀硫酸的反应
(2)根据下列离子方程式,各写一个符合条件的化学 方程式
方程式
①Fe+2H+====Fe2++H2↑
②HCO3-+ H+====CO2↑+ H2O
(1)在氧化还原反应中,反应物中某元素化合价升高,则该反应物发生_______反应(填
“氧化”或“还原”,下同),做_______剂;从电子转移角度分析,________剂得到电子,发生________反应。
(2)火药 是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:
是中国的“四大发明”之一,永远值得炎黄子孙骄傲,也永远会激励着我们去奋发图强。黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S===K2S+2NO2↑+CO2↑。其中被还原的元素是(填元素符号),
还原剂是(填化学式,下同),氧化产物是。