现有某XY3气体m g,它的摩尔质量为M g·mol-1。若阿伏加德罗常数用NA表示,则:
(1)该气体的物质的量为
(2)该气体所含原子总数为 个
(3)该气体在标准状况下的 体积为
体积为
(4)该气体 溶于1L水中(不考虑反应)
溶于1L水中(不考虑反应) ,其溶液中溶质的质量分数为
,其溶液中溶质的质量分数为
(5)该气体溶于水后形成VL溶液,其溶液的物质的量浓度为 ;
将该溶液加水稀释至原体积的2倍后,再取出50mL稀释后的溶液,则取出溶液的物质的量浓度为
(6)标准状况下,相同体积的另一种气体CH4含有氢原子的物质的量为
下表为长式周期表的一部分,其中的编号代表对应的元素。
请回答下列问题:
(1)表中属于ds区的元素是(填编号)。
(2)表中元素①的2个原子与元素③的2个原子形成的分子中元素③的杂化类型是;
③和⑦形成的常见化合物的化学键类型是。
(3)元素⑧的外围电子排布式为,该元素原子中未成对电子数为。
(4)在周期表中位于对角线的元素的性质也有一定的相似性。试写出元素②的氢氧化物与NaOH溶液反应的化学方程式:.
(5)在1183 K以下,元素⑨形成如图1所示基本结构单元的晶体;1183 K以上,转变为图2所示基本结构单元的晶体。

在1183 K以下的晶体中,与元素⑨的原子等距离且最近的原子数为;
在1183 K以上的晶体中,与元素⑨原子等距离且最近的原子数为。
(B).
已知亚甲基蓝其氧化型呈蓝色,还原型呈无色,其转化关系式为:
奇妙的“蓝瓶子”实验就是利用上述原理,其装置如图1。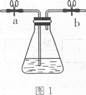

某校化学兴趣小组用图1装置进行下述实验:
①在250 mL锥形瓶中,依次加入2g NaOH、100mlH2O和2g葡萄糖,搅拌溶解后,再加入3~5滴0.2%的亚甲基蓝溶液,振荡混合液呈蓝色;
②塞紧橡皮塞,关闭活塞a、b,静置,溶液变为无色;
③打开活塞、振荡,溶液又变为蓝色;
④关闭活塞、静置,溶液又变为无色;
⑤以上步骤③、④可重复多次。
请回答下列问题:
(1)若塞紧图1中锥形瓶塞,并打开导管活塞a、b,从导管口(填“左”或“右”)通入足量氦气后,再关闭活塞a、b并振荡,溶液(填“能”或“不能”)由无色变为蓝色。
(2)如图2所示:某学生将起初配得的蓝色溶液分装在A、B两支试管中,A试管充满溶液,B中有少量溶液,塞上橡皮塞静置片刻,两溶液均显无色。若再同时振荡A、B试管,溶液显蓝色的是试管。
(3)上述转化过程中葡萄糖的作用是,亚甲基蓝的作用是
(4)上述实验中葡萄糖也可用鲜橙汁(其中含丰富维生素C)代替,这是因为。
(5)该实验中③、④操作(填“能”或“不能”)无限次重复进行,理由是。
现有五种短周期元素A、B、C、D、E,其原子序数依次增大。A、E同主族,A元素原子半径最小。B元素原子的最外层电子数是内层电子数的2倍。C元素最高价氧化物的水化物X与其氢化物Y反应生成一种盐。A、B、C、E四种元素都能与D元素形成原子个数比不相同的常见化合物。试回答下列问题:
(1)写出X与Y反应生成这种盐的化学方程式。
(2)A、B、D、E四种元素组成的某无机盐受热易分解。写出少量该化合物与足量的 Ba(OH)2溶液反应的离子方程式。
(3)将B的某种单质用作电极,电解E元素的最高价氧化物水化物的溶液时,阳极的电极反应式为。
(4)在一密闭容器中注入A2、C2两种气体,发生了“ ”的化学反应。在某温度下达到平衡时,各物质的浓度分别是:c(A2)="9.00" mol·L-1,c(C2) ="3.00" mol·L-1,c(CA3) ="4.00" mol·L-1。则此时该反应的平衡常数K=;C2的初始浓度为mol·L-1;A2的转化率是%。
”的化学反应。在某温度下达到平衡时,各物质的浓度分别是:c(A2)="9.00" mol·L-1,c(C2) ="3.00" mol·L-1,c(CA3) ="4.00" mol·L-1。则此时该反应的平衡常数K=;C2的初始浓度为mol·L-1;A2的转化率是%。
某一资料中记载着可以用电解KI水溶液的方法进行KIO3的工业化生产的信息,总的电解反应方程式为:KI+3H2O KIO3+3H2↑。
KIO3+3H2↑。
(1)据此推测:
①阳极反应式是;
②阴极反应式是。
(2)一位学生想演示这一方法,则他应该准备的物品和试剂是。
某蓄电池因使用日久而正负极标志模糊。请根据另外找到的下列两组器材和试剂,回答两种判断该正负极模糊的蓄电池的正负极的方法。
(1)氯化铜溶液,两根带有铜导线的碳棒:。
(2)硫酸铜溶液,两根铜导线:。
在150 mL 0.2 mol·L-1硫酸铜溶液中插入两个电极,通电电解(不考虑水的电解),则:
(1)若两极均为铜片,试说明电解过程中Cu2+浓度将怎样变化。
。
(2)若阳极为纯锌,阴极为铜片,阳极的电极反应式是。
(3)如不考虑H+在阴极上放电,当电路中有0.04 mol e-通过时,阴极增重g,阴极上的电极反应式是。