运用化学反应原理分析解答以下问题
(1)250℃时,以镍合金为催化剂,向4L容器中通人6 mol CO2、6 molCH4,发生如下反应:CO2(g)+CH4(g)  2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
| 物质 |
CH4 |
CO2 |
CO |
H2 |
| 体积分数 |
0.1 |
0.1 |
0.4 |
0.4 |
①此温度下该反应的平衡常数K=___________.
②若再向容器中同时充入2.0molCO2、6.0 molCH4、4.0 molCO和8.0 molH2,则上述平衡向_____(填“正反应”或“逆反应”)方向移动。
(2)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
已知:① NO2(g)+SO2(g)  SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
SO3(g)+NO(g) ΔH= —41.8KJ·mol-1
②2SO2(g)+O2(g)  2SO3(g) ΔH= —196.6KJ·mol-1
2SO3(g) ΔH= —196.6KJ·mol-1
①写出NO和O2反应生成NO2的热化学方程式__________。
②一定温度下,向2L恒容密闭容器中充人NO2和SO2各1 mol,5min达到平衡,此时容器中NO和NO2的浓度之比为3:1,则NO2的平衡转化率是_________。
(3)常温下有浓度均为0.1 mol/L的四种溶液:①Na2CO3、②NaHCO3、③HCl、④NH3.H2O。
①有人称溶液①是油污的“清道夫”,原因是_________(用离子方程式解释)
②上述溶液中,既能与氢氧化钠反应,又能和硫酸反应的溶液中离子浓度由大到小的顺序为__________。
③向④中加入少量氯化铵固体,此时c(NH4+)/ c(OH-)的值_________(填“增大”“减小”或“不变”)。 ④若将③和④的溶液混合后溶液恰好呈中性,则混合前③的体积_________④的体积(填“大于”小于”或“等于”)
⑤将10 mL溶液③加水稀释至100 mL,则此时溶液中由水电离出的c( H+)=___________。
元素周期表与元素周期律在学习、研究和生产实践中有很重要的作用。下表列出了①~⑨九种元素在周期表中的位置。
| 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
⑤ |
⑥ |
||||||
| 3 |
① |
③ |
④ |
⑦ |
⑨ |
|||
| 4 |
② |
⑧ |
请回答:这九种元素分别是①(填元素符号,下同)、②、④、⑤、⑥、⑧、其中化学性质最不活泼的是。
在①、②、③三种元素的氧化物对应的水化物中,碱性最强的是(填化学式)。
⑥元素的氢化物是 (填化学式),该氢化物在常温下与②发生反应的化学方程式为 。
⑧元素与①元素形成的化合物是(填化学式),高温下灼烧该化合物时,火焰呈色。
某同学做元素性质递变规律实验时,
设计了一套实验方案,记录了有关实验现象。
| 实验步骤 |
实验现象 |
| ① 将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 |
A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色 |
| ②将一小块金属钠放入滴有酚酞溶液的冷水中 |
B.有气体产生,溶液变成浅红色 |
| ③将镁条投入稀盐酸中 |
C.反应不十分剧烈;产生无色气体 |
| ④将铝条投入稀盐酸中 |
D.剧烈反应,迅速产生大量无色气体 |
请帮助该同学整理并完成实验报告。实验目的:研究元素性质递变规律。
实验内容:(填写与实验步骤对应的实验现象的编号)
| 实验内容 |
① |
② |
③ |
④ |
|
| 实验现象(填A-D) |
写出实验①、②对应化学方程式
实验①,
实验②。实验结论: 。
某温度时,在2L容器中X、Y、Z三种物质随时间的变化关系曲线如图所示。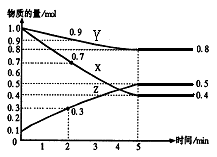
由图中的数据分析,该反应的化学方程式为;
反应开始至2min、5min时Z的平均反应速率分别为、;
开始min后,反应达到最大限度。
(8分)下列几组物质中,互为同位素的有__________,互为同素异形体的有________,互为同系物的有____________,互为同分异构体的有___________,属于同种物质的有__________。
①O2和O3 ②35Cl和37Cl ③CH3CH3和CH3CH2CH3
④CH3CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
⑤氯仿和三氯甲烷
⑥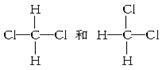
⑦CH3(CH2)2CH3和(CH3)2CHCH3⑧CH3CH(CH3)CH3和CH(CH3)3
从铁、盐酸、氧气、水、碳酸钙五种物质中选出一种或两种作为反应物,按下列要求的反应类型各写一个化学方程式
(1)化合反应
(2)分解反应
(3)置换反应
(4)复分解反应