(131分)某利,盐溶解后得到的溶液中,可能含有Fe2+、Fe3+、SO42-、NH4+、Ba2+、CO32-离子中的某几种。
(1)甲同学做如下实验:①取少量溶液于试管中逐滴加人浓氢氧化钠溶液,发现先生成白色沉淀,迅速变为灰绿色,最后变为红揭色,并有刺激性气体生成;②另取少量溶液于试管中,加人少量盐酸酸化的氯化钡溶液,有白色沉淀生成。该溶液中一定含有的离子是_____;写出①中白色沉淀转化为红褐色沉淀的化学方程式__________________。
(2)乙同学做如下实验:取少量溶液于试管中,滴加几滴硫氰酸钾溶液,无明显现象;再滴加H2O2发现溶液变红色。继续滴加H2O2,红色逐渐褪去且有气泡产生。为弄清其中缘由,他查阅资料知:
①该反应中,被氧化的元素为__________,每生成1molCO2转移的电子数为___________;
②根据乙同学的实验现象,请判断还原性强弱为:Fe2+__________SCN-(填<、=或>);
③根据资料,乙同学提出的猜想是:H2O2将SCN-氧化使红色逐渐褪去。请你设计一个实验,验证乙同学的猜想是否正确_____________________________________________。
甲烷水蒸气重整制合成气是利用甲烷资源的途径之一,该过程的主要反应是
反应①:CH4(g)+ H2O(g)  CO(g) + 3H2(g) ΔH > 0
CO(g) + 3H2(g) ΔH > 0
(1)已知:
CH4(g)+ 2O2(g) = CO2(g) + 2H2O(g)ΔH1= -802 kJ·mol-1
CO(g) + 1/2O2(g) = CO2(g)ΔH2 = -283 kJ·mol-1
H2(g) + 1/2O2(g) = H2O(g)ΔH3 = -242 kJ·mol-1
则反应①的ΔH =_________(用ΔH1、ΔH2和ΔH3表示)。
(2)其他条件相同,反应①在不同催化剂(Ⅰ、Ⅱ、Ⅲ)作用下反应相同时间后,CH4的转化率随反应温度的变化如图所示。
①在相同条件下,三种催化剂Ⅰ、Ⅱ、Ⅲ的催化效率由高到低的顺序是________。
②a点所代表的状态________(填“是”或“不是”)平衡状态。
③c点CH4的转化率高于b点,原因是________。
(3)反应①在恒容密闭反应器中进行,CH4和H2O的起始物质的量之比为1︰2,10 h后CH4的转化率为80%,并测得c(H2O)=0.132 mol·L-1,计算0~10 h内消耗CH4的平均反应速率_____(写出计算过程,结果保留2位有效数字)。
(4)在答题卡的坐标图中,画出反应①分别在700℃和850℃下进行时,CH4的转化率随时间t变化的示意图(进行必要标注)。
羰基化反应是制备不饱和酯的有效途径,如:
反应①:
化合物I可由化合物Ⅲ合成:
(1)化合物Ⅱ的分子式为________,化合物Ⅱ在NaOH溶液中完全水解的化学方程式为_________。
(2)化合物Ⅲ的结构简式为________,化合物Ⅳ通过消去反应生成化合物I的化学方程式为______(注明反应条件)。
(3)化合物Ⅴ是化合物Ⅱ的同分异构体,苯环上有两个取代基且能发生银镜反应,Ⅴ的核磁共振氢谱除苯环峰外还有两组峰,峰面积之比为1︰2,Ⅴ的结构简式为_________(写一种即可)。
(4)聚合物 单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
单体的结构简式为_________。用类似反应①的方法,利用丙炔与合适的原料可以合成该单体,化学方程式为________。
华法林是一种治疗心脑血管疾病的药物,可由化合物E和M在一定条件下合成得到(部分反应条件略)。
(1)A的名称为__________________,A→B的反应类型为_____________________
(2)D→E的反应中,加入的化合物X与新制Cu (OH)2反应产生砖红色沉淀的化学方程式为____________________________________________________________
(3)G→J为取代反应,其另一产物分子的结构简式为__________________
(4)L的属于酯类的同分异构体有______种;L的同分异构体Q是芳香酸,Q经下列反应
得到T。T的核磁共振氢谱只有两组峰,则Q的结构简式为,R→S的化学方程式为____________________________
(5)已知:L→M的原理为:① 和②
和② ,M的结构简式为。
,M的结构简式为。
按要求完成下列各小题。
(1)甲中显酸性的官能团是(填名称)。
(2)下列关于乙的说法正确的是(填序号)。
a.分子中碳原子与氮原子的个数比是7 : 5
b.属于芳香族化合物
c.既能与盐酸又能与氢氧化钠溶液反应
d.属于苯酚的同系物
(3)写出丙物质与足量NaOH溶液共热的化学方程式。
(4)已知以下信息:

1molB经上述反应可生成2molC,且C不能发生银镜反应。
则由A生成B的化学方程式为
(5) 的一种同分异构体满足下列条件:
的一种同分异构体满足下列条件:
Ⅰ.能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应。
Ⅱ.分子中有6种不同化学环境的氢,且分子中含有两个苯环。
写出该同分异构体的结构简式:。
(6)已知有下列反应:
试写出只用1,3-丁二烯合成六元环化合物的结构简式。
“低碳循环”引起各国的高度重视,而如何降低大气中CO2的含量及有效地开发利用CO2,引起了全世界的普遍重视。所以“低碳经济”正成为科学家研究的主要课题。
(1)用电弧法合成的储氢纳米碳管常伴有大量的碳纳米颗粒(杂质),这种颗粒可用如下氧化法提纯,请完成该反应的化学方程式,并在方框内填上系数。
□C+□KMnO4+□H2SO4=□CO2↑+□MnSO4 +□K2SO4+□
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应CO(g)+H2O(g) CO2(g)+H2(g),得到如下二组数据:
CO2(g)+H2(g),得到如下二组数据:
| 实验组 |
温度℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
||
| CO |
H2O |
H2 |
CO |
|||
| 1 |
650 |
4 |
2 |
1.6 |
2.4 |
6 |
| 2 |
900 |
2 |
1 |
0.4 |
1.6 |
3 |
①实验1条件下,反应从开始至达到平衡,以v(CO2)表示的反应速率为(保留小数点后二位数,下同)。
②实验2条件下平衡常数K=,该反应为 (填“吸热”或“放热”)反应。
(3)已知在常温常压下:
①2CH3OH(l) +3O2(g)=2CO2(g)+4H2O(g)ΔH1=-1275.6 kJ/mol
②2CO (g)+ O2(g)=2CO2(g)ΔH2=-566.0 kJ/mol
③H2O(g)=H2O(l)ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式:。
(4)某实验小组依据甲醇燃烧的反应原理,设计如图所示的电池装置。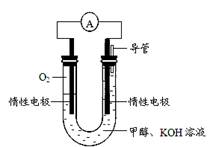
该电池正极的电极反应式为;该电池工作时,溶液中的OH-向(填“正”或“负”)极移动。