(18分)某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。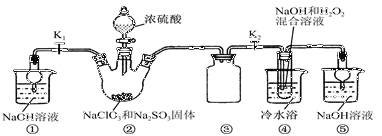
(1)装置③的作用是 装置①的作用是
(2)装置②中制备ClO2的化学方程式为 ;产生ClO2的还原剂是装置④中制备NaClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:①准确称取所得亚氯酸钠样品mg于小烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果 (填“偏高”或“偏低”),原因用离子方程式表示为 。
将1 L含有0.4 mol CuSO4和0.2 mol NaCl 的水溶液用惰性电极电解一段时间后。
(1)若在一个电极上得到0.1 mol Cu,另一电极上析出气体(在标准状况下)的体积是________ L。
(2)若在一个电极上恰好得到0.4 mol Cu,另一电极上再析出气体(在标准状况下)的体积是________ L。
钼是一种过渡金属元素,通常用作合金及不锈钢的添加剂,这种元素可增强合金的强度、硬度、可焊性及韧性,还可增强其耐高温及耐腐蚀性能。如图是化工生产中制备金属钼的主要流程图。
(1)写出反应①的化学方程式:。
(2)反应①的尾气可以再利用,写出应用该尾气制得的两种重要化学试剂。
(3)如果在实验室模拟操作1和操作2,则需要使用的主要玻璃仪器有。
(4)钼在空气中灼烧生成三氧化钼,三氧化钼溶于氢氧化钠溶液生成钼酸钠;三氧化钼不溶于盐酸或稀硫酸。钼酸钠的化学式为。
(5)工业上制备还原性气体CO和H2的反应原理为CO2+CH4 2CO+2H2,CH4+H2O
2CO+2H2,CH4+H2O CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
CO+3H2。含甲烷体积分数为80%的a L(标准状况)天然气与足量二氧化碳和水蒸气的混合物在高温下反应,甲烷转化率为90%,用产生的还原性气体(CO和H2)还原MoO3制钼,理论上能生产钼的质量为。
废旧硬质合金刀具中含碳化钨(WC)、金属钴(Co)及少量杂质铁,利用电解法可回收WC和Co。工艺流程简图如下:
(1)电解时废旧刀具做阳极,不锈钢做阴极,HCl溶液为电解液。阴极主要的电极反应式为。
(2)净化步骤所得滤饼的主要成分是。回收的洗涤液代替水配制电解液,目的是回收利用其中的。
(3)溶液Ⅰ的主要成分是。洗涤CoC2O4不充分对最终产品纯度并无明显影响,但焙烧时会造成环境污染,原因是。
(4)将Co2O3还原成Co粉的化学反应方程式为。
铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示;
请回答下列问题:
(1)固体a的化学式为,Ⅲ中通入足量CO2气体发生反应的离子方程式为。
(2)由Ⅴ制取铵明矾溶液的化学方程式为,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)、冷却结晶、过滤洗涤。
(3)以1 000 kg含氧化铝36%的铝土矿为原料制取Al2(SO4)3,需消耗质量分数98%的硫酸(密度1.84 g·cm-1L(保留一位小数)。
(4)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为。
MnO2是一种重要的无机功能材料,粗MnO2的提纯是工业生产的重要环节。某研究性学习小组设计了将粗MnO2(含有较多的MnO和MnCO3)样品转化为纯MnO2的实验,其流程如下: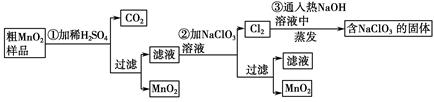
(1)第①步加稀H2SO4时,粗MnO2样品中的(写化学式)转化为可溶性物质。
(2)第②步反应的离子方程式是 +
+ ClO3-+
ClO3-+ =
= MnO2↓+
MnO2↓+ Cl2↑+
Cl2↑+ 。
。
(3)第③步蒸发操作必需的仪器有铁架台(含铁圈)、、、,已知蒸发得到的固体中有NaClO3和NaOH,则一定还含有(写化学式)。
(4)若粗MnO2样品的质量为12.69 g,第①步反应后,经过滤得到8.7 g MnO2,并收集到0.224 L CO2(标准状况下),则在第②步反应中至少需要mol NaClO3。