短周期元素A、B、C、D、E原子序数依次增大,A与C可形成A2C2和A2C两种化合物;B的最高价氧化物对应的水化物甲与其气态氢化物乙反应可生成盐丙;D与A位于同一主族;在同周期元素形成的简单离子中,E的离子半径最小。
(1)实验室中可用A2C2制取C单质,其化学方程式是 。
(2)由A、C、D三种元素组成的化合物的电子式是 ;B、C、E三种元素组成的常见盐的水溶液呈酸性,原因是 (用离子方程式表示)。
(3)常温下,若甲、丙两溶液的pH均等于5,则由水电离出的c(H+)甲:c(H+)丙= ;丙溶液中所含离子的物质的量浓度由大到小的顺序是 。
(4)0.1molD单质和0.2molE单质组成的混合物投入到足量的A2C中,产生气体的体积(标准状况)是 。
(5)反应乙+C2→B2+A2C(未配平)可设计为燃料电池,则通入乙的电极是 (填“正”或“负”)极,在碱性条件下其电极反应是 。
汽油不仅是最重要的燃料,而且是重要的化工原料,它既可以裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原料的下列衍变关系,写出相应的化学方程式及所属反应类型。
(1) ;反应类型;
;反应类型;
(2);
(3);
(4);反应类型。
某烃A与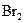 发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为
发生加成反应,生成二溴衍生物B;用加热的NaOH乙醇溶液处理B得到化合物C;经测试知C的分子中含有两个双键,分子式为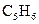 ;将C催化加氢生成环戊烷。试写出A、B、C的结构简式。
;将C催化加氢生成环戊烷。试写出A、B、C的结构简式。
(1)A.___ _____、B.__ ______、C.________。
(2)写出由B得化合物C的反应方程式;该反应的反应类型是反应
(3)已知卤代烃可以和钠发生反应,例如溴乙烷与钠发生反应为:2CH3CH2Br + 2Na → CH3CH2CH2CH3  + 2NaBr应用这一反应,下列所给化合物中可以与钠合成环丁烷的是:
+ 2NaBr应用这一反应,下列所给化合物中可以与钠合成环丁烷的是:
A.CH3Br B.CH3CH2CH2CH2Br C.CH2BrCH2CH2Br D.CH2BrCH2CH2CH2Br
Ⅰ.(1)有机物 名称是;
名称是;
(2)2,3,3-三甲基戊烷的结构简式为;
(3)下列各物质中,互为同位素的是,互为同素异形体的是,互为同系物的是,互为同分异构体的是,属于同一种物质的是。

Ⅱ.烷烃分子中的基团可能有四种:—CH3、—CH2—、 ,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
,其数目分别用a、b、c、d表示,对烷烃(除甲烷外)中存在的关系作讨论:
(1)下列说法正确的是()
| A.a的数目与b的数目的大小无关 | B.c增加l,a就 会增加3 会增加3 |
| C.d增加1,a就会增加2 | D.b增加1,a就会增加2 |
(2)四种基团之间的关系为:a=(用a、b、c、d表示)
《化学与技术》
20-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列有关工业生产的叙述正确的是()
A.合成氨生产过程中将NH3液化分离,可以提高N2、H2转化率
B.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量
C.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的Cl2进入阳极室
D.电解精炼铜时,同一时间内阳极溶解铜的质量比阴极析出铜的质量小
E.炼铁过程中碳被氧化,既起产生热量的作用,又起产生CO的作用
20-2.海南省是海洋大省,海水是人类宝贵的自然资源,从海水中可以提取多种化工原料,下图是某工厂对海水资源综合利用的示意图:
(1)请列举海水淡化的两种方法、。
(2)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br -,其目的是:。
步骤Ⅱ用SO2水溶液吸收Br2,吸收率可达95%,有关反应的离子方程式
(3)在制取无水氯化镁时需要在干躁的HCl气流中加热MgCl2.6H2O的原因
(4)电解无水氯化镁所得的镁蒸气在特定的环境里冷却后即为固体镁,下列物质中可以
用做镁蒸气的冷却剂的是()
A.H2 B.CO2
C.空气 D.O2 E.水蒸气
(5)从各种经营综合开发,打造大而强的现代企业以及本厂生产所需要的原料等方面来
看,你认为该化工厂还可以再增加的生产项目的。
《物质结构与性质》
19-1.(6分,该题为多项选择题,全选对得6分,漏选按比例给分,错选或多选为0分)下列说法正确的是()
| A.基态原子中不一定都有未成对的电子 |
| B.由极性键形成的分子一定是极性分子 |
| C.晶格能大小顺序:NaCl > KCl |
| D.离子晶体中每个阳离子周围均吸引着6个带相反电荷的离子 |
E.在CaO和SiO2晶体中,都不存在单个小分子
19-2.四种常见元素的性质或结构信息如下表,试根据信息回答有关问题。
| 元素 |
A |
B |
C |
D |
| 性质 结构 信息 |
基态原子核外有两个电子层,最外层有3个未成对的电子 |
基态原子的M层有1对成对的p电子 |
基态原子核外电子排布为[Ar]3d104sx,有+1、+2两种常见化合价 |
有两种常见氧化物,其中有一种是冶金工业常用的还原剂 |
(1)写出B原子的基态电子排布式。
(2)A元素的氢化物的沸点比同主族相邻元素氢化物沸点(填“高”或“低”),其原因是。
(3)D元素最高价氧化物的熔点比同主族相邻元素最高价氧化物的熔点(填“高”或“低”),其原因是。
(4)往C元素的硫酸盐溶液中逐滴加入过量A元素的氢化物水溶液,可生成的配合物的化学式为,简要描述该配合物中化学键的成键情况。
(5)下列分子结构图中的“●”表示上述相关元素的原子中除去最外层电子的剩余部分,“ O”表示氢原子,小黑点“ ·”表示没有形成共价键的最外层电子,短线表示共价键。
则在以上分子中,中心原子采用sp3杂化形成化学键的是(填写序号);在②的分子中有个σ键和个π键。