下图甲是CO2电催化还原为碳氢化合物的工作原理示意图,用一种钾盐水溶液作电解液;图乙是用H2还原CO2制备甲醇的工作原理示意图,硫酸为电解质溶液。下列说法不正确的是

| A.甲中铜片作阴极,K+向铜片电极移动 |
B.乙中正极发生的电极反应为CO2+6e-+6H+ CH3OH+H2O CH3OH+H2O |
| C.乙中H2SO4的作用是增强溶液的导电性 |
| D.甲中若CxHy为C2H4,则生成1 mol C2H4的同时生成2 molO2 |
向某二价金属M的M(OH)2溶液中加入过量的NaHCO3溶液,生成了MCO3沉淀,过滤,将沉淀置于足量的稀盐酸中,充分反应后,在标准状况下收集到V L气体,如果计算金属M的相对原子质量,你认为还必须提供下列哪项数据( )
| A.M(OH)2溶液的物质的量浓度 |
| B.与MCO3反应的盐酸的物质的量浓度 |
| C.MCO3的质量 |
| D.题给条件充足,不需要再补充数据 |
我国科学家在世界上第一次为一种名为“钴酞菁”的分子(直径为1.3×10-9m)恢复了磁性。“钴酞菁”分子结构和性质与人体内的血红素及植物体内的叶绿素非常相似。下列说法不正确的是( )
| A.“钴酞菁”分子所形成的分散系具有丁达尔效应 |
| B.“钴酞菁”分子既能透过滤纸,也能透过半透膜 |
| C.此项工作可以用来改变分子的某些物理性质 |
| D.此工作可广泛应用于光电器件、生物技术等方面 |
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)/mol·L-1为()
| A.(y-2x)/a | B.(y-x)/a |
| C.(2y-2x)/a | D.(2y-4x)/a |
在三个密闭容器中分别充入Ne、H2、O2三种气体,当它们的温度和密度都相同时,这三种气体的压强(p)从大到小的是()
| A.p(Ne)>p(H2)>p(O2) | B.p(O2)>p(Ne)>p(H2) |
| C.p(H2)>p(O2)>p(Ne) | D.p(H2)>p(Ne)>p(O2) |
下列叙述正确的是( )
| A.相同条件下,M2和O2的混合气体与等体积的N2所含原子数相等 |
| B.等物质的量的甲基(—CH3)与羟基(—OH)所含电子数相等 |
| C.常温常压下28 g CO与22.4 L O2所含分子数相等 |
D.16 g CH4与19 g 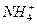 所含质子数相等 所含质子数相等 |