常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法不正确的是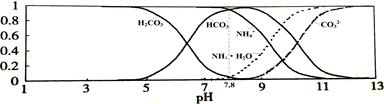
| A.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)=c(HCO3-)+c(CO32-)+c(H2CO3) |
| B.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小 |
| C.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3) |
| D.当溶液的pH=9时,溶液中存在下列关系:c(HCO3-)>c(NH4+)>c(NH3·H2O)>c(CO32-) |
从海水中制得的氯化钠除食用外,还可用作工业原料,生成多种含钠或氯的化工产品,利用CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl的反应原理可制备纯碱,下面是在实验室进行模拟实验的生产流程示意图:饱和食盐水溶液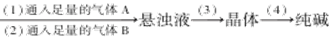
则相关的说法错误的是
| A.通入的气体:A是CO2,B是NH3 |
| B.NaHCO3溶解度比NaCl、Na2CO3、NH4HCO3和NH4Cl的溶解度都小 |
| C.步骤(3)的操作为过滤,滤液可作化学肥料 |
| D.步骤(4)中,将晶体加热分解可以得到纯碱 |
在不同温度下,向V L密闭容器中加入0.5 mol NO和0.5 mol活性炭,发生反应:
2NO(g)+C(s)  N2 (g)+CO2 (g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
N2 (g)+CO2 (g) △H= —Q kJ·mol-1(Q>0),达到平衡时的数据如下:
| 温度/℃ |
n (C)/mol |
n(CO2)/mol |
| T1 |
0.15 |
|
| T2 |
0.375 |
下列有关说法正确的是
A.由上述信息可推知:T1 > T2
B.T2℃时,若反应达平衡后再缩小容器的体积,c (N2):c (NO)增大
C.T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率增大
D.T1℃时,该反应的平衡常数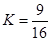
绿原酸的结构简式如图,下列有关绿原酸的说法错误的是
| A.分子式为C16H18O9 |
| B.能与NaHCO3反应 |
| C.能发生取代反应、氧化反应和消去反应 |
| D.1 mol绿原酸最多与6 mol Br2反应 |
下列与金属腐蚀有关的说法正确的是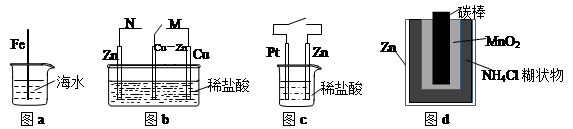
| A.图a中,插入海水中的铁棒,越靠近底端腐蚀越严重 |
| B.图b中,开关由M改置于N时,Cu—Zn合金的腐蚀速率减小 |
| C.图c中,接通开关时Zn腐蚀速率增大,Zn上放出气体的速率也增大 |
| D.图d中,Zn—MnO2干电池自放电腐蚀主要是由MnO2的氧化作用引起的 |
下列操作能达到实验目的的是
| A.为鉴别KCl、AlCl3和MgCl2溶液,分别向三种溶液中滴加NaOH溶液至过量 |
| B.在纯锌与稀硫酸的反应混合物中滴入少量Cu(NO3)2溶液后生成H2的反应速率加快 |
| C.各放一张质量相同的滤纸于天平的两托盘上,将NaOH固体放在左盘上称量 |
| D.用右图所示装置吸收氨气可防倒吸 |
