某校初三化学学习小组的同学前往某地的石灰石矿区进行调查,他们取回矿石样品,对样品中的碳酸钙的质量分数进行检测,采用了以下的办法:
甲组同学:
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生成CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量。右图为大理石与稀盐酸反应的反应装置,并测量CO2的体积。(其他仪器省略)
(1)下图中左侧的橡皮管的作用是 。下图中装置中油层的作用是 。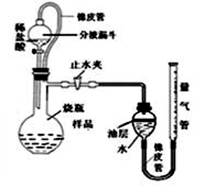
(填操作方法)可使反应前后油层上方气体压强和外界大气压相同,此时排出水的体积即为生成二氧化碳的体积。
乙组同学:
【查阅资料】1.氢氧化钠溶液可以吸收二氧化碳气体
2.碱石灰可以吸收二氧化碳气体和水分
取样品,研成粉状后,按下图进行实验。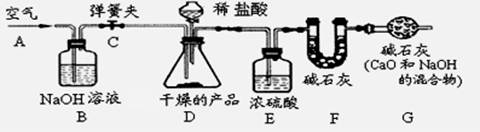
(1)实验步骤:
①连接好装置,检查气密性;
②打开弹簧夹C,在A处缓缓通入一段时间空气;
③称量F的质量;
④关闭弹簧夹C,慢慢滴加稀盐酸至过量,直至D中无气泡冒出;
⑤打开弹簧夹C,再次快速通一段时间空气;
⑥称量F的质量,计算前后两次质量差。最后根据CO2的质量求出样品中碳酸钙的质量
(2)问题探究:
①产品研成粉状的目的 ;
②B装置的作用是 ;
G装置的作用是 。
③若没有E装置,则测定的CaCO3的质量分数会 (填“偏大 偏小 不变”)。
④在步骤②打开弹簧夹C,在A处缓缓通入一段时间空气的目的是 。
总结反思:
(1)甲组同学们认为即使排除实验仪器和操作的影响,测定的结果仍不一定准确,甲组中,可能造成实验结果与真实值相比偏小的原因是 。
(2)在乙组实验步骤中,可能造成实验结果与真实值相比偏大的原因是 。
化学是认识物质、改选物质和应用物质的科学,从化学视角看食品添加剂,主要是从其元素组成与结构、物理化学性质及在人体内的变化等方面,下表中给出了4种食品添加剂,试回答有关问题:
(1)请你在下表空白处填上物质的化学式。
| 物质的组成与性能 |
被用于食品添加剂 |
|||
| 物质名称 |
物质组成 (填化学式) |
主要化学性质及在人体内变化 |
类别或作用 |
法律规定 |
| 碳酸氢钠 |
无毒、弱碱性,易与胃酸反应 |
膨松剂 |
可用 |
|
| 硫酸铜 |
增色 |
国家严禁使用 |
||
| 铁(还原性铁粉) |
抗氧化剂 |
依据国家标准可用 |
||
| 甲醛 |
CH2O |
防腐 |
(2)从应用物质的角度,人们常常根据物质的性质对物质进行分类,其原因在于
_______________________________________________________________,从性质上看,国家严格禁止甲醛和硫酸铜作为食品添加剂,是因为_______________________________;
在研究或认识物质的性质时,又常常根据物质的组成和结构对物质进行分类,其原因在于
_______________________________________________________________。
(3)还原性铁粉用于食品添加剂,除能够防止食品因氧化而变质外,还是一种营养强化剂,这是因为_______________________________________________________________。
通过学习碱的性质,我校化学兴趣小组的同学对实验室的“氢氧化钙是否变质以及变质的程度”展开了探究活动,请你一同参与:
(1)提出问题:氢氧化钙是否变质?
(2)猜想与假设:同学们经过讨论认为样品存在三种可能情况:没有变质;部分变质;完全变质。
(3)实验探究:
| 实验步骤及操作 |
实验现象 |
实验结论 |
| 取样于试管中,加入足量蒸馏水振荡,静置 ①取上层清液,滴入无色酚酞试液 ②倒去上层清液,再向试管中注入稀盐酸 |
①无色酚酞试液变红 ② |
部分变质 |
| ①无色酚酞试液不变红 ② |
||
| ① ②没有气泡产生 |
(4)小结与思考:
①小蔓同学根据上述实验方案进行实验,确定该样品已部分变质,请写出实验中反应的化学方程式:
,。
②氢氧化钙俗称熟石灰,农业上常用来。
在实验探究过程中,如果有多种因素同时影响某一实验结果,当我们要探究其中的一种因素时,就要保持其他因素保持不变,以探究此种因素对实验结果的影响。
完成实验探究:哪些因素影响固体物质在水中的溶解度?
因素1:溶质的种类
在实验中要改变的因素是:溶质的种类
要保持不变的因素是:温度
操作步骤:在常温下,将NaCl、KNO3、Ca(OH)2各2g,分别加入①、②、③三支试管中,用量筒各量取5mL蒸馏水,倒入①、②、③三支试管中,并不断(填操作步骤)一段时间,观察各物质的溶解情况。
实验现象:试管①中有少量NaCl未溶,试管②中KNO3全部溶解,试管③中有较多Ca(OH)2未溶。
实验结论:在___________保持不变的情况下,不同种类固体物质在水里的溶解度___________(填“相等”或“不相等”)。
因素2:温度(以KNO3为例)
在实验中要改变的因素是:______________
要保持不变的因素是:溶质的种类(KNO3)
操作步骤:用量筒各量取用量筒各量取5mL蒸馏水,分别加入①、②、③三支试管中,再分别加入5gKNO3晶体,将试管①保持在常温下,将试管②加热并保持在40℃,将试管③加热并保持在60℃,振荡,观察各试管中KNO3的溶解情况。
实验现象:试管①中有多量KNO3未溶,试管②中有少量KNO3未溶,试管③中KNO3全部溶解。
实验结论:在不同温度下,固体物质(KNO3)在水里的溶解度__________(填“相等“或”不相等)。
某化学兴趣小组进行溶液的配制和粗盐的初步提纯实验。
(1)配制200g质量分数为8%的氢氧化钠溶液:
①计算:需要氢氧化钠固体的质量为克,需要水的体积为mL(水的密度近似看作1g/mL)。
②称量:调节托盘天平平衡,将一个烧杯放在托盘天平的盘,称量其质量。然后(按操作的先后顺序选填字母),直至天平平衡。
A.将氢氧化钠固体加入烧杯中 B.按需要添加砝码、移动游码
该步骤中用烧杯而不用纸称量氢氧化钠的原因是。
③用量取所需要的水,倒入盛有氢氧化钠固体的烧杯中,用搅拌,使其溶解,并冷却到室温。
④将配制好的溶液放入试剂瓶,塞好橡胶塞并,放到指定的地方。
(2)粗盐的初步提纯:
①称取5.0克粗盐,用药匙逐渐加入到10mL水中,直到粗盐不再溶解为止。还需进行的实验操作步骤的顺序为:称量剩余粗盐、(填编号)。
A.过滤 B.计算产率 C.蒸发 D.称量精盐
②过滤操作如右图所示,指出其中的错误之处:
;;
;。
(16分)请你参与下列探究。
【问题情景】某化学实验小组同学将铁粉投入硫酸铜溶液中,发现生成红色固体物质的同时,有较多的气泡放出。这一现象激发起同学们的探究欲望,生成的是什么气体呢?
【提出猜想】从物质组成元素的角度分析,放出的气体可能是SO2、O2、H2。
【查阅资料】SO2易溶于水,它能与NaOH溶液反应,生成Na2SO3。
【方案设计】依据上述猜想,实验小组同学分别设计了如下方案:
(1)甲同学认为是O2,则检验方法是。
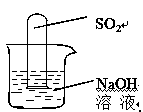
(2)乙同学认为是SO2,则只需将放出的气体通入盛有NaOH溶液的洗气瓶中,称量通气前后洗气瓶的质量。写出SO2与NaOH反应的化学方程式:。
(3)实验小组同学合作设计了如下组合实验方案,排除和验证猜想的气体。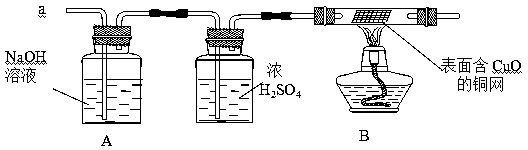
如果放出的是O2和H2的混合物,你认为方案中的安全隐患是。
丙同学认为:为确保安全,实验前应先进行验纯操作。
【实验探究】经丙同学确认安全后,小组同学首先对装置A进行称量,再将收集到的气体从a通入,过一会儿点燃B处酒精灯;一段时间后,发现表面含CuO的铜网由黑色变为光亮的红色;停止通气,再次称量装置A,发现质量不变。
结论:(1)铁粉与硫酸铜溶液反应时,产生的气体是 。
(2)写出该气体与CuO反应的化学方程式:。
【思维拓展】
(1) 由上述实验可以推出,硫酸铜溶液显 (选填“酸”或“碱”)性。
(2) 不通过称量,如何判断SO2与NaOH溶液发生了反应呢?有一同学设计了右图所示的装置进行实验,发现试管内液面上升,就得出SO2与NaOH溶液发生反应的结论。其他同学认为这一方案不严谨,理由是 。要得到科学严谨的结论,仍利用该装置,补做的实验是。