某化肥厂以氨和空气(其中氧气的体积分数为0.2)为原料生产硝酸铵过程如下:
(1)步骤②发生了两个反应,将这两个化学方程式合并为一个化学方程式,可表示为 。
(2)若不考虑副反应且各步反应均完全,为使生产过程中不再补充空气,则原料气中氨(包括第③步被硝酸吸收的氨)的体积分数最大值为 。
(3)假设实际生产中,反应①、②中含氮物质的利用率分别为a、b,反应③中氨的利用率为c,硝酸的利用率为100%,则合成硝酸铵的整个流程中,氨的总利用率是 。(用含a,b,c的表示式)。
(7分).化合物C是医用功能高分子材料,可由化合物A(C4H8O3)制得,如下图所示,B和D互为同分异构体。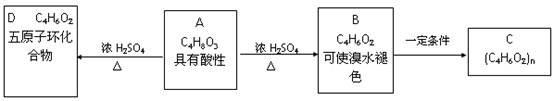
试写出下列反应的化学方程式
A→B
B→C
试写出下列反应的反应类型
A→B B→C A→D
.如下图所示:淀粉水解可产生某有机化合物A,A在不同的氧化剂作用下,可以生成B(C6H12O7)或C(C6H10O8),B和C都不能发生银镜反应。A、B、C都可以被强还原剂还原成为D(C6H14O6)。B脱水可得到五元环的酯类化合物E或六元环的酯类化合物F。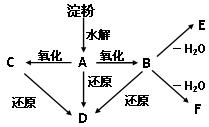
已知,相关物质被氧化的难易次序是:
RCHO最易, R—CH2OH次之, 最难。
最难。
(1)请写出C、D的结构简式:C:__________D:______________________
(2)请写出下列反应的化学方程式
①淀粉水解A:__________________________________________
②A发生银镜反应:______________________________________
③B → F:_____________________________________________
(9分).邻羟基苯甲酸(俗名水杨酸)其结构简式为 :
:
(1).水杨酸既可以看成是__________类物质,同时也可以看成是_____________类物质。
(2).将其与_______________溶液作用生成物的化学式为C7H5O3Na
将其与_______________溶液作用生成物的化学式为C7H4O3Na2
(3).水杨酸的不同类同分异构体中,属于酚类且也具有苯环的化合物的结构简式为______________,它还可看成是__________类物质。
(4).比水杨酸多一个CH2原子团,且与水杨酸属于同系物的取代基数目不同的两类物质的结构简式分别为___________________ ________________
(5).比水杨酸多一个CH2原子团,且与水杨酸不属于同系物的两类物质的结构简式分别为_________________________________________
(15分)向一个体积可变的密闭器中充入4molA、1molB,发生如下反应:
4A(g)+B(s)  3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
3C(s)+4D(g)。在高温下达到平衡,测得混合气体中D的浓度为0.3mol·L-1。
请填写下列空白:
(1)若容器体积为10L,反应经2min达平衡,则以A物质浓度变化表示的化学反应率为
。
(2)若压缩容器增大压强,则逆反应的速率,容器中D的体积分数。(填“增大”“减小”“不变”)
(3)若相对分子质量M(B)>3M(C),温度升高时混合气体的平均相对分子质量减少,则正反应。(填“吸热”或“放热”)
(4)在最初的容器改充1.5molC、4.4molD温度保持不变,要使反应达平衡时D的浓度为0.6mol·L-1,则容器的体积是L。
(16分)已知 —C(OH)2—不稳定. 由丙烯经下列反应可得到F、G两种高分子化合物,它们都是常用的塑料。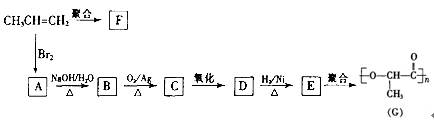
(1)聚合物F的结构简式是。
(2)D的结构简式是。
(3)B转化为C的化学方程式是
(4)在一定条件下,两分子E能脱去两分子水形成一种六元环状化合物,该化合物的结构简式。
(5)写出 C 与新制备的银铵溶液反应的化学方程式
(6)写出同时符合下列条件:①含有—OH的酯②水解产物稳定(一个碳原子上接两个羟基,存在―O―O-键的物质不稳定)
属于D的同分异构体的结构简式: