下列离子方程式书写正确的是
| A.H218O中投入Na2O2固体:2H218O+2Na2O2===4OH-+4Na++18O2↑ |
| B.Fe3O4与稀HNO3反应:Fe3O4+8H+===Fe2++2Fe3++4H2O |
C.向NaHCO3溶液中加入少量Ca(OH)2:HCO3-+Ca2++OH ===CaCO3↓+H2O ===CaCO3↓+H2O |
| D.将少量NaOH溶液加入到NH4HCO3溶液中:OH-+HCO3-===CO32-+H2O |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.常温条件下,11.2L甲烷气体含甲烷分子数为0.5NA |
| B.标准状况下,22.4L Cl2通入水中,反应过程中转移电子数为NA |
| C.常温条件下,0.1mol·L-1的氢氧化钠溶液中含钠离子数为0.1NA |
| D.标准状况下,16g O2和O3的混合气体中含氧原子数为NA |
下列离子方程式书写正确的是
| A.向CuCl2溶液中加入少量氨水:Cu2++2OH一=Cu(OH)2↓ |
| B.向海带灰的浸出液中(酸性)加入双氧水制取I2:2I一+H2O2+2H+=I2+2H2O |
C.足量稀硫酸与氢氧化钡溶液混合:Ba2++OH一+SO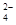 +H+=BaSO4↓+H2O +H+=BaSO4↓+H2O |
| D.铝溶于氢氧化钠溶液:2Al+2OH一+3H2O=2[Al(OH)4]一+3H2↑ |
利用下列装置进行相应实验,不能达到实验目的的是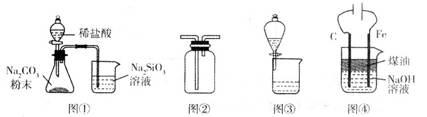
| A.图①装置可验证酸性:H2CO3>H2SiO3 |
| B.图②装置可用于收集气体H2、CO2、Cl2、NH3 |
| C.图③装置可用于分离互不相溶的两种液体 |
| D.图④装置可制备Fe(OH)2并能较长时间保持其颜色 |
下列说法错误的是
| A.任何化学反应都伴随着能量变化 |
| B.电解质溶液的导电过程就是电解的过程 |
| C.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质 |
| D.胶体和溶液的本质区别是能否发生丁达尔现象 |
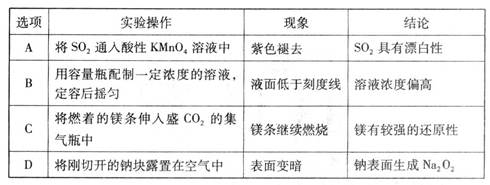
下列实验操作、现象及结论均正确的是