下列叙述正确的是
| A.常温下,将pH=3的醋酸溶液稀释到原体积的10倍,稀释后溶液的pH=4 |
| B.25℃时Ksp(AgCl)=1.8×10—10,向AgCl沉淀的溶解平衡体系中加入NaCl固体,AgCl的溶解度可能增大 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小的排列顺序为:NaOH>Na2CO3>(NH4)2SO4>NaHSO4 |
| D.为确定H2A是强酸还是弱酸,可测NaHA溶液的pH,若pH >7,则H2A是弱酸;若pH<7,则H2A是强酸 |
下列关于醇与酚的比较中,正确的是
| A.醇和酚的结构中都含有羟基 |
| B.醇能与钠反应放出氢气,而酚不能 |
| C.醇、酚的水溶液都能使石蕊试纸变红 |
| D.醇和酚都能与氢氧化钠溶液发生中和反应 |
下列关于苯酚的叙述中,不正确的是
| A.其水溶液显酸性,俗称石炭酸 |
| B.苯酚暴露在空气中,会因与CO2作用而变质 |
| C.在水中的溶解度随温度的升高而增大,超过65℃可与水混溶 |
| D.其浓溶液对皮肤有强烈的腐蚀性,如果不慎沾在皮肤上,应立即用酒精擦洗 |
关于乙醇在化学反应中断键位置说法错误的是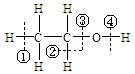
| A.乙醇与钠反应,在④位置断裂,对比钠与水反应,乙醇比水更难失去氢离子。 |
| B.乙醇与浓硫酸在170℃时,在②③位置断裂,以水分子的形式消去,属于消去反应。 |
| C.乙醇与浓硫酸在140℃时,在③或④位置断裂,该反应取代反应。 |
| D.乙醇在铜催化下与氧气反应,在②④位置断裂,所以只有与羟基直接相连的碳原子上有氢原子才能发生催化氧化。 |
下列关于乙烯和乙烷的说法中,不正确的是
| A.乙烯属于不饱和链烃,乙烷属于饱和链烃 |
| B.乙烯分子中所有原子处于同一平面上,乙烷分子中的原子不在同一平面上 |
C.乙烯分子中的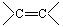 双键比乙烷分子中的C—C单键更稳定,性质更活泼 双键比乙烷分子中的C—C单键更稳定,性质更活泼 |
| D.乙烯能使酸性KMnO4溶液褪色,乙烷不能 |
下列关于有机化合物的说法正确的是
| A.乙醇和乙酸都存在碳氧双键 |
| B.甲烷和乙烯都可以与氯气反应 |
| C.高锰酸钾可以氧化苯和甲烷 |
| D.乙烯可以与氢气发生加成反应,苯不能与氢气加成 |