(选考)【化学—选修2:化学与技术】
近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化。共生工程将会大大促进化学工业的发展。
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V。实际过程中,将SO2通入电池的 极(填“正”或“负”),负极反应式为 ;用这种方法处理SO2废气的优点是 。
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质。合成路线如下:
① 生产中,向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是 。
② 下列有关说法正确的是 (填序号)。
| A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙 |
B.反应III中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑ |
| C.反应IV需控制在60~70℃,目的之一是减少碳酸氢铵的分解 |
| D.反应V中的副产物氯化铵可用作氮肥 |
③ 反应V中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是 。
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统。写出二氧化氮与亚硫酸铵反应的化学方程式 。
对于反应2SO2+O2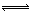 2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
2SO3(g),当其他条件不变时,只改变一个反应条件,将生成的SO3的反应速率的变化填入下表空格内(填“增大”、“减小”或“不变”)。
| 编号 |
改变的条件 |
生成SO3的速率 |
| ① |
降低温度 |
|
| ② |
压缩体积 |
|
| ③ |
增大氧气的浓度 |
|
| ④ |
使用催化剂 |
欲制无水氯化铝并保存备用。现有仪器如下图所示,并有浓盐酸、水、固体烧碱、铝粉、二氧化锰、浓硫酸、碱石灰(主要成分为CaO, NaOH)、食盐固体等八种试剂。
设计的制取过程是:制氯气 → 净化和干燥氯气 →制氯化铝
查资料得知:无水AlCl3极易与水作用而变质:AlCl3易升华
 |
请回答下列问题:
(1)从上列仪器中选取必须的几种,连接成一个制无水氯化铝的连续装置,按前后顺序填写图的编号(可以重复使用)。
仪器编号 、 、 、 、 、 ④
(2)写出实验过程中有关反应的化学方程式(任意2个)。
(3)以上连接装置中最后连接④的作用是
a、b、c、d、e、f、g为七种由短周期元素构成的粒子,它们都有10个电子,其结构特点如下:
其中b的离子半径大于e的离子半径;d是由极性键构成的四原子分子;试写出:
(1)、写出下列粒子的电子式:
①c__________;②d__________;③e__________;④a__________。
(2)、b与e相应元素的最高价氧化物对应水化物的碱性强弱比较为:__________>__________(用化学式表示)。
(3)、用电子式表示b元素与氧形成的化合物b2O的形成过程:________________。
苯环上原有的取代基对新导入苯环上的取代基的位置有一定影响,其规律是:
①苯环上新导入的取代基所占的位置主要决定于原有取代基的性质。
②可以把原有取代基分成两类:第一类如:―OH,―X(Cl,Br), ,—R等,可使新导入的取代基进入苯环的邻位和对位;第二类如—NO2、—SO3H、—CHO等,可使新导入的取代基进入苯环的间位。当第一类和第二类同时存在时,以第一类为准。
,—R等,可使新导入的取代基进入苯环的邻位和对位;第二类如—NO2、—SO3H、—CHO等,可使新导入的取代基进入苯环的间位。当第一类和第二类同时存在时,以第一类为准。
(1)请写出图中第②步反应的化学方程式及C的结构简式。
②的化学方程式是。
(2)C的结构简式为。
(3)写出同分异构体D,E的结构简式:D;E。
航天飞机常用新型燃料电池作为电能来源,燃料电池一般指采用H2、CH4等可燃物质与O2一起构成的电池装置。它可直接将化学能转化为电能,甲烷电池以KOH溶液为电解质,其总反应的化学方程式为CH4+2O2+2OH-==CO32-+3H2O。
(1)负极上的电极反应为。
(2)消耗16.8 L(标准状况下)O2时,有mol 电子发生转移。
(3)开始放电时,正极附近溶液的氢氧根离子浓度(填“增大”、“减小”或“不变”)。