小琴同学设计了图所示的A、B两个实验.
(1)实验时,她为了除去铁丝和银丝表面的氧化物或污物,其操作是________________.
(2)A实验的目的是________________________;实验时,将铁丝和银丝同时插入稀硫酸中,可观察到的现象是________________________________________________________;所发生反应的化学方程式为________________________________________.
(3)B实验中,当烧杯内盛有________溶液时,可验证Fe、________________、Ag三种金属的活动性强弱.
实验课上同学们对酸碱盐的性质作了如下探究。
(1)小海探究了中和滴定实验,操作如下图甲所示,当他观察到____________时,说明恰好完全反应。写出反应的化学方程式__________________。
(2)小郝对一瓶敞口放置的氢氧化钠溶液产生兴趣,他想探究该溶液是否完全变质。取样后先加入__________溶液,有白色沉淀生成。过滤。滤液中加入无色酚酞溶液,观察到溶液变红,他推断该氢氧化钠溶液部分变质。
(3)小亮则根据所学知识绘制了如下图所示物质间关系网络图,并做了相关实验。(“—”表示相连的两种物质能发生反应,“→”表示某物质可以转化为另一种物质。)已知A为胃酸的主要成分,B是贝壳的主要成分,D微溶于水,A与F反应生成气体。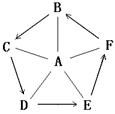
① 写出物质D的俗称__________;
② 写出C→D 的现象_________;
③ 写出E→F的化学方程式_____________________;
④ 写出物质E的一点用途_________________;
结合下列实验室装置图,按要求回答下列问题。
(1)写出图中标号a的仪器名称 a____________
(2)实验室用加热氯酸钾的方法制取并收集较为纯净的氧气时,可选择的装置为_________,写出反应的化学方程式_____________________。
(3)装置C与装置B相比,优点是___________________________。
(4)写出一例用装置C和D制取气体的化学方程式_____________________。
(5)能用E装置收集的气体应具有的性质为________________。
在学习盐的化学性质时,老师将一定量的碳酸钠溶液与氯化钡溶液混合,过滤反应后的混合物.老师要求同学们探究滤液中溶质的组成.请你一同参与探究并回答有关问题.
【查阅资料】碳酸钠溶液显碱性,氯化钠,氯化钡溶液显中性.
请你写出碳酸钠溶液与氯化钡溶液反应的化学方程式.
【提出猜想】
猜想1:滤液中溶质是
;
猜想2:滤液中溶质是
和(填化学式)的混合物;
猜想3:滤液中溶质是
和
的混合物;
【实验探究】
(1)取少量滤液于试管中,滴加2~3滴无色酚酞试液,振荡,无明显现象.同学们认为猜想不成立.
(2)另取少量滤液于另一支试管中,滴加碳酸钠溶液,若有(填实验现象)证明猜想2成立.
【问题讨论】
(1)甲同学认为要证明猜想2成立也可以改用硫酸钠溶液.你认为甲同学(填"能"或"不能")达到实验目的.
(2)乙同学认为要证明猜想2成立也可以改用硝酸银溶液.你认为乙同学(填"能"或"不能")达到实验目的.理由是.
某化学兴趣小组根据右图所示进行模拟炼铁的实验,并对产物成分进行探究。
经初步分析:无色气体A不含有单质气体,黑色粉末B含有两种单质中的一种或者两种。
高炉炼铁的原理为:
,请写出反应器中一氧化碳是如何产生的化学方程式:。
兴趣小组又分成甲乙两组分别对无色气体A和黑色粉末B的成分进行探究。
【猜想与假设】
甲组在分析了炼铁的原理后,认为无色气体A中可能有
,也可能有未反应的。
乙组认为黑色粉末的成分中存在以下三种情况:
假设一:只含有铁。假设二:只含有。假设三:以上两种物质都含有。
【实验探究】
(1)为验证甲组的猜想,大家按下图示进行实验(箭头表示气体流向):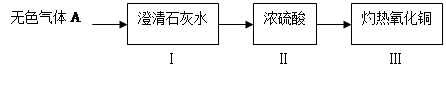
当看到Ⅰ中澄清石灰水变浑浊,Ⅲ中灼热的氧化铜变红,可以确定无色气体A的成分为:,Ⅱ中浓硫酸的作用是:。
(2)为验证乙组中假设三成立,大家用物理和化学两种方法来进行探究
| 实验方法 |
实验操作 |
实验现象 |
实验结果 |
| 物理方法 |
假设三成立 |
||
| 化学方法 |
取少量黑色粉末B于试管中,加入过量的稀盐酸 |
假设三成立 |
写出黑色粉末B中加入过量的稀盐酸反应的化学方程式:。
【交流反思】
在做甲组的实验中发现其存在一个很不环保的缺陷,请指出来。
我国大部分地区深受酸雨的危害,煤燃烧产生的
是形成酸雨的主要污染物,
与水结合生成弱酸性亚硫酸
.
已知:
易分解生成水和
,也易与空气中的氧气或稀硝酸反应生成
;
和
都能使红色的品红溶液褪色.
(1)酸雨是
小于的降雨.
(2)常用脱硫方法减少废气中的
,以生石灰
为脱硫剂,高温下与废气中的
与
化合生成
,化学方程式为.
(3)实验室常用亚硫酸盐与 或 反应制备 , 与盐酸反应的化学方程式.
(4)小鸿同学利用中和反应的原理,在空气中放置一段时间的酸雨(
约为3)中加入足量的
,并就反应后混合溶液的中盐成分进行如何探究:
【提出猜想】反应后的混合溶液中盐的成份是什么?
【进行猜想】猜想1:只有
猜想2:
猜想3:既有
,也有
【实验探究】限选试剂:稀硫酸、稀盐酸、稀硝酸、氯化钡溶液、澄清石灰水、品红溶液、紫色石蕊溶液
| 步骤 |
实验操作 |
预期现象与结论 |
| 1 |
各取
反应后的混合溶液分别加入
两只试管 |
|
| 2 |
向
试管中滴加足量的稀硫酸,随即滴入几滴红色品红溶液 |
证明含有 |
| 3 |
向 试管中,加入,再加入足量的. | 先有白色沉淀,后有气体产生,沉淀部分溶解,证明含有
,则猜想3成立 |