一个体重50 kg的健康人含铁元素2 g,这2 g铁元素以Fe2+和Fe3+的形式存在。Fe2+易被吸收,所以给贫血者补充铁时,应补充含Fe2+的亚铁盐(如FeSO4)。服用维生素C可使食物中的Fe3+转化成Fe2+,有利于人体对铁的吸收。
(1)经常进行Fe2+与Fe3+的转化,可表示为Fe2+ Fe3+。
Fe3+。
在过程A中,Fe2+作 剂。
维生素C可使食物中的Fe3+转化为Fe2+,维生素C在这个反应中具有 性。
(2)某些补铁剂的成分是硫酸亚铁,长期放置会因氧化而变质。检验硫酸亚铁是否变质的试剂是______________(填序号)。
①稀盐酸 ②石蕊溶液 ③KSCN溶液
(3)要除去FeCl3溶液中少量的氯化亚铁,可行的办法是 (填字母)。
a.加入铜粉 b.加入铁粉 c.通入氯气 d.加入NaOH溶液
根据选用的试剂,写出该过程中发生反应的离子方程式 。
(4)电子工业常用30%的FeCl3 溶液腐蚀铜箔,制造印刷线路板,写出FeCl3 与金属铜反应的离子方程式 。
现有甲、乙、丙三名同学分别进行Fe(OH)3胶体的制备实验。
I、甲同学向1 mol·L-1氯化铁溶液中加入少量的NaOH溶液;
II、乙同学直接加热饱和FeCl3溶液;
III、丙同学向25 ml沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热。
试回答下列问题:
(1)其中操作正确的同学是;他的操作中涉及到的化学反应方程式为。
(2)证明有Fe(OH)3胶体生成的实验操作及现象是。
(3)丁同学将所制得的Fe(OH)3胶体分成两份,并进行下列实验:
①将其中一份装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附近的颜色逐渐变深,这表明。
②向另一份中不断滴加稀硫酸,观察到的现象是。
.[化学——选修5:有机化学基础]
已知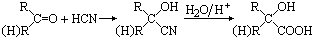 ,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1∶2可以制得G,有机玻璃可按下列路线合成:
(1)A、E的结构简式分别为:、;
(2)B→C、E→F的反应类型分别为:、;
(3)写出下列转化的化学方程式:
C→D;
G+F→H;
(4)要检验B中的Br元素,可用的操作和现象为。
(5)写出符合下列要求的H的同分异构体①有一个支链②能使溴的四氯化碳溶液褪色③跟NaHCO3反应生成CO2,。(只要求写出2个)
[化学——选修3:物质结构与性质](15分)前四周期原子序数依次增大的元素A、B、C、D中A和B的价电子层中未成对电子均只有1个,并且A-和B+的电子数相差为8;与B位于同一周期的C和D,它们价电子层中的未成对电子数分别为4和2,且原子序数相差为2。回答下列问题:
(1)D2+的价层电子排布图为。
(2)四种元素中第一电离能最小的是,电负性最大的是。(填元素符号)
(3)A、B和D三种元素组成的一个化合物的晶胞如图所示。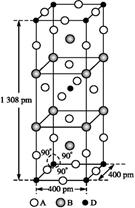
①该化合物的化学式为,D的配位数为;
②列式计算该晶体的密度g·cm-3。
(4)A-、B+和C3+三种离子组成的化合物B3CA6,其中化学键的类型有;
(5)该化合物中存在一个复杂离子,该离子的化学式为,配位体是。
[化学——选修2:化学与技术](15分)草酸(乙二酸)可作还原剂和沉淀剂,用于金属除锈、织物漂白和稀土生产。一种制备草酸(含2个结晶水)的工艺流程如下: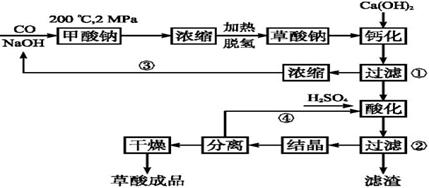
回答下列问题:
(1)CO和NaOH在一定条件下合成甲酸钠、甲酸钠加热脱氢的化学反应方程式分别为、。
(2)该制备工艺中有两次过滤操作,过滤操作②的滤液是和,滤渣是。
(3)工艺过程中③和④的目的是。
(4)有人建议甲酸钠脱氢后直接用硫酸酸化制备草酸。该方案的缺点是产品不纯,其中含有的杂质主要是____________________。
(5)结晶水合草酸成品的纯度用高锰酸钾法测定。称量草酸成品0.250 g溶于水,用0.050 0 mol·L-1的酸性KMnO4溶液滴定,至浅粉红色不消褪,消耗KMnO4溶液15.00 mL,反应的离子方程式为;列式计算该成品的纯度。
(1)25℃时,在0.10mol/L的氨水中逐滴加入同浓度的盐酸(不计两者的挥发性),回答下列问题:
①当溶液pH=7时,溶液中c(NH4+)c(Cl-)(用“<”、“>”、“=”填空,下同);
②当盐酸和氨水溶液恰好中和时,溶液中c(H+)c(OH-);
(2)某工厂用FeCl3溶液腐蚀镀有铜的绝缘板生产印刷电路。某实验小组的同学对该厂生产的印刷电路后所得的废液进行了分析:取50mL废液,向其中加入足量的稀硝酸,生成0.02molNO;另取50mL废液,向其中加入足量的AgNO3溶液,析出沉淀43.05g。
请回答以下问题:
①该厂原来使用的FeCl3溶液中溶质的物质的量浓度为_____(反应前后溶液的体积变化忽略不计);
②废液中各金属阳离子的物质的量浓度之比为C(Fe3+):C(Fe2+):C(Cu2+)=__________;
③另取50mL废液,加入一定量铁屑,充分反应后有铜析出,则所得溶液中Fe2+的物质的量范围是。