一氧化碳与氢气在催化剂作用下合成甲醇的反应为:CO(g)+2H2(g) CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图,温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是
CH3OH(g)。在容积均为1L的a、b、c、d、e5个密闭容器中分别充入1mol CO和2mol H2等量混合气体,控温。实验测得相关数据如图,温度分别为300℃、500℃的密闭容器中,甲醇的物质的量与时间的关系;温度分别为T1~T5的密闭容器中,反应均进行到5min时甲醇的体积分数.下列有关说法正确的是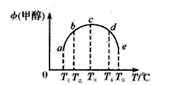
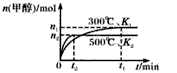
| A.K1 < K2 |
| B.该反应的正反应是气体体积减小的吸热反应 |
| C.将容器c中的平衡态转变到容器d中的平衡态,可采取的措施有升温或减压 |
| D.反应到5min时,a、b两容器中平衡正向移动,d、e两容器中平衡逆向移动 |
下列说法或表达正确的是()
①次氯酸的电子式为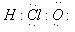
②含有离子键的化合物都是离子化合物
③强电解质溶液的导电能力一定比弱电解质溶液强
④丁达尔效应可用于区别溶液和胶体,云、雾均能产生丁达尔效应
⑤将金属a与外加直流电源的正极相连,将负极接到废铁上,可防止金属a被腐蚀
| A.①③⑤ | B.②④ | C.①②③ | D.④⑤ |
A、B都是短周期元素,原子半径B>A,它们可形成化合物AB2,由此可以得出的正确判断是()
A.原子序数:A>B B.A和B可能在同一主族
C.A可能在第二周期ⅣA族 D.A肯定是金属元素
由短周期元素组成的中学常见无机物A、B、C、D、E、X,存在如在右图转化关系(部分生成物和反应条件略去)下列推断不正确的是()
A.若X是 ,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
,C为含极性键的非极性分子,则A一定是氯气,且D和E不反应
B.若A是单质,B和D的反应是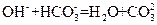 ,则E一定能还原
,则E一定能还原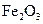
C.若D为CO,C能和E反应,则A一定为 ,其电子式是
,其电子式是
D.若D为白色沉淀,与A摩尔质量相等,则X一定是铝盐
X、Y、Z、M是元素周期表中前20号元素,其原子序数依次增大,且X、Y、Z相邻。X的核电荷数是Y是核外电子数的一半,Y与M可形成化合物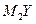 。下列说法正确的是()
。下列说法正确的是()
| A.还原性:X的氧化物>Y的氧化物>Z的氢化物 |
| B.简单离子的半径:M的离子>Z的离子>Y的离子>X的离子 |
C.YX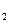 M M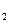 Y都是含有极性键的极性分子 Y都是含有极性键的极性分子 |
| D.Z元素的最高价氧化物的水化物的化学式为HZO4 |
下列关于砷(As)元素的叙述中,不正确的是()
| A.在AsCl3分子中,砷原子最外层电子数为8 | B.Na3AsO4溶液的pH大于7 |
| C.砷的氢化物的化学式为AsH3,它是一种强氧化剂 | |
| D.砷的相对原子质量为74.92,由此可知砷原子核内约有42个中子 |