某燃煤发电厂的废气中有SO2,它是形成酸雨的罪魁之一。处理SO2一般用生石灰或类似物质来吸收。下图是处理该废气的装置示意图。下列说法不正确的是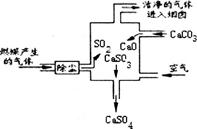
| A.此过程中既有分解反应,也有化合反应 |
| B.CaSO4既是氧化产物,又是还原产物 |
| C.使用此废气处理装置可减少酸雨的形成 |
| D.理论上整个过程每转移电子1mol,会对应生成1molCO2 |
下列图示与对应的叙述相符的是 ( )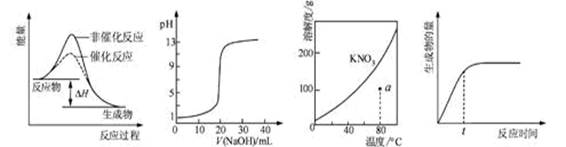
图1图2图3图4
| A.图1表示某吸热反应分别在有、无催化剂的情况下反应过程中的能量变化 |
| B.图2表示0.1000 mol·L-1NaOH溶液滴定20.00mL0.1000 mol·L-1CH3COOH溶液所得到的滴定曲线 |
| C.图3表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的饱和溶液 |
| D.图4表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时v正 > v逆 |
25℃时,若体积Va、PH=a的某一元强酸溶液与体积Vb、pH=b的某一元强碱溶液混合,恰好中和,且已知Va<Vb,a=0.5b,a的取值范围是()
| A.7/2<a<14/3 | B.7<a<14 | C.3<a<5 | D.9/2<a<15/2 |
某温度下在,密闭容器中发生如下可逆反应:2M(g)+N(g)  2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
2E(g),若开始时只充入2 mol E(g),达平衡时,E的转化率为40%;若开始时充入2 mol M和1 mol N的混合气体,达平衡时混合气体的压强比起始时减少了
| A.20% | B.40% | C.60% | D.80% |
25℃时,在水电离出的C(H+)=1×10-12摩/升的溶液中,一定能大量共存的是 ( )
| A.Al3+、NH4+、SO42-、Cl- | B.Mg2+、K+、SO42-、HCO3- |
| C.K+、Na+、Cl-、SO42- | D.K +、Cl-、Na+、PO43- |
用标准盐酸滴定未知浓度的NaOH溶液时,若测定结果偏高,则产生误差的原因可能是
| A.滴定时,装NaOH溶液的锥形瓶未用NaOH溶液润洗 |
| B.酸式滴定管用蒸馏水洗后,又用标准溶液润洗 |
| C.滴定前,酸式滴定管尖嘴处有气泡,而在滴定后气泡消失 |
| D.滴定前以仰视的姿势读取了酸式滴定管的读数,滴定后读数正确 |