由铝硅两种物质组成的试样11 g,均匀地分成等质量的两份,一份与足量的盐酸接触可产生气体a L,一份与足量的NaOH溶液接触产生同样的气体b L,则此试样中铝与硅的质量比为
| A.4a /3(b-a) | B.9a/7(b-a) | C.a/(b-a) | D.无法计算 |
仅用下表提供的玻璃容器(非玻璃容器任选)就能实现相应实验目的的是( )
| 选项 |
实验目的 |
玻璃容器 |
| A |
分离乙醇和乙酸乙酯的混合物 |
分液漏斗、烧杯 |
| B |
用pH=1的盐酸配置100mL,pH=2的盐酸 |
100mL容量瓶、烧杯、玻璃棒、胶头滴管 |
| C |
用溴水、淀粉—KI溶液比较Br2与I2的氧化性强弱 |
试管、胶头滴管 |
| D |
用NH4Cl固体和Ca(OH)2固体制备并收集NH3 |
酒精灯、烧杯、导管、集气瓶 |
W、X、Y、Z四种短周期元素在元素周期表中的相对位置如图所示,W的气态氢化物可与其最高价含氧酸反应生成离子化合物,由此可知( )
| W |
X |
|
| Y |
Z |
A.X、Y、Z中最简单氢化物稳定性最弱的是Y
B.Z元素氧化物对应水化物的酸性一定强于Y
C.X元素形成的单核阴离子还原性大于Y
D.Z元素单质在化学反应中只表现氧化性
下列有关说法不正确的是( )
| A.新制Cu(OH)2浊液既可以区别甲酸钠和乙酸钠,也可以区别乙醇和甘油 |
| B.食醋总酸含量测定实验中,标准液NaOH既可以滴定未知浓度的食醋,也可被食醋滴定,前者用酚酞做指示剂,后者用甲基橙做指示剂 |
| C.石油分馏中使用冷凝管目的是冷凝获得产物,阿司匹林及硝基苯制备中垂直长导管(如上图)目的之一是冷凝回流反应物 |
| D.过滤时漏斗下端与烧杯内壁要保持接触,分液时分液漏斗下端与锥形瓶(或烧杯)内壁也要保持接触 |
下列金属防腐的措施中,使用外加电流的阴极保护法的是( )
| A.水中的钢闸门连接电源的负极 | B.金属护拦表面涂漆 |
| C.汽车底盘喷涂高分子膜 | D.地下钢管连接镁块 |
下列说法正确的是( )
A.按系统命名法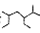 的名称为2一甲基一3,5一二乙基己烷 的名称为2一甲基一3,5一二乙基己烷 |
| B.用Na2 C03溶液能区分CH3COOH、CH3CH2OH,苯、硝基苯四种物质 |
| C.等质量的甲烷、乙烯、1,3一丁二烯分别充分燃烧,所耗氧气的量依次增加 |
| D.下列物质的沸点按由低到高顺序为:(CH3CH2)2CH3<(CH3)3CH<CH3(CH2)3CH3<(CH3)2CHCH2CH3 |