现有一混合物的水溶液,可能含有以下离子中的若干种: K+、NH4+ 、Ba2+、CO32-、Cl-、SO42--。现取两份200 mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36 g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54 g,经足量盐酸洗涤、干燥后,沉淀质量为4.66 g。根据上述实验,以下推测正确的是
| A.一定存在K+、NH4+、CO32-、SO42-,一定不存在Ba2+、Cl- |
| B.一定存在NH4+、Cl-、CO32-、SO42-,可能存在K+ |
| C.c(SO42-)="0.2" mol·L-1,c(NH4+)>c(SO42-) |
| D.如果溶液中存在NH4+、Cl-、CO32-、SO42-、K+五种离子,则c(K+)>0.2 mol·L-1 |
下列现象不能用氢键解释的是
| A.冰的密度小于液态水 | B.有机物普遍存在同分异构现象 |
| C.HF的沸点高于HI | D.NH3容易液化 |
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是
| A.第一电离能:③>②>① | B.原子半径:③>②>① |
| C.电负性:③>②>① | D.最高正化合价:③>②>① |
下列各组物质的晶体中,化学键类型相同,晶体类型也相同的是
| A.SiO2和SO2 | B.NaCl和HCl |
| C.CO2和H2O | D.CH4和KCl |
下列各式能真实表示物质分子组成的是
| A.SO2 | B.CaCl2 | C.SiO2 | D.Na2O2 |
下列表达方式错误的是
A.甲烷的电子式: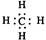 |
B.氟化钠的电子式: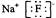 |
| C.硫离子的核外电子排布式:1s22s22p63s23p4 |
D.碳-12原子: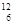 C C |