下表是某铬酸(H2CrO4)溶液中离子浓度(mol·L-1)与pH的关系,下列说法不正确的是
| pH |
c(CrO42-) |
c(HCrO4-) |
c(Cr2O72-) |
c(H2CrO4) |
| 4 |
0.0003 |
0.1040 |
0.4480 |
0 |
| 6 |
0.0319 |
0.0999 |
0.4370 |
0 |
| 7 |
0.2745 |
0.0860 |
0.3195 |
0 |
| 9 |
0.9960 |
0.0031 |
0.0004 |
0 |
A.铬酸的第一步电离是完全电离
B.铬酸的第二步电离是部分电离,且存在两种电离方式
C.pH越大,电离出的CrO42-浓度越大
D.当电离达到平衡时,2v逆(Cr2O72-)= v正(HCrO4-)
某短周期元素的最高价氧化物所对应的水化物的化学式为HxROy,气态氢化物的化学式为HzR(或RHz)。已知1molHxROy比1molHzR质量多64g,下列说法不正确的是()
| A.2y-x+z=8 | B.y=4 |
| C.R一定是硫元素 | D.R一定处于第三周期 |
下列说法正确的是()
| A.任何化学反应都伴随着能量的变化 |
| B.1 mol H2SO4和 1 mol Ba(OH)2完全反应所放出的热量称为中和热 |
| C.在101kPa 时,1 mol 碳燃烧放出的热量就是碳的燃烧热 |
| D.在化学反应中需要加热的反应就是吸热反应 |
用NA表示阿伏加德罗常数的值。下列叙述正确的是()
| A.常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA |
| B.标准状况下,22.4L己烷中共价键的数目为19NA |
| C.由CO2和O2组成的混合物中共有NA个分子,则其中的氧原子数为2NA |
| D.1L浓度为1mol·L-1的Na2CO3溶液中含有NA个CO32- |
2010年诺贝尔物理学奖授予英国曼彻斯特大学的两位科学家,以表彰他们在石墨烯材料方面的卓越研究。石墨烯是由石墨剥离而成,其是由碳原子构成的单层片状结构的新材料(结构如图),性质稳定导电性好,有望代替硅可能引发电子工业革命。下列说法中正确的()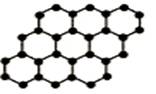

A.石墨烯与石墨互为同位素 |
B.0.12g石墨烯中含有6.02×1022个碳原子 |
C.石墨烯是一种有机物 |
D.石墨烯中的碳原子间以共价键相结合 |
下列离子方程式书写正确的是
| A.铝粉投入氢氧化钠溶液中:2Al+2OH- |
| B.氯化铝溶液中加入足量的氨水:Al3++3NH3·H2O |
| C.氯化铁溶液中加入铁粉:Fe3+ +Fe |
D.碳酸钙与盐酸反应: CO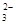 +2H+ +2H+ |