下列有关化学平衡移动叙述,正确的是
A.可逆反应:Cr2O742-+H2O 2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一 2CrO42-+2H+达平衡状态溶液呈橙黄色,滴加少量的浓硝酸,溶液变橙色,氢离子浓度随时间变化曲线如上图一 |
B.可逆反应Co(H2O) 62++ (粉红色)+4Cl- CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二 CoCl42-+ (蓝色)+6H2O达平衡状态溶液呈紫色,升高温度,溶液变蓝色,反应速率随时间变化曲线如上图二 |
C.可逆反应:2NO2 N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三 N2O4达平衡状态呈红棕色,加压(缩小体积)红棕色变深,NO2物质的量随时间变化曲线如上图三 |
D.可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四 2NH3(g) ΔH<0达平衡状态,升高温度,NH3体积分数随时间变化曲线如上图四 |
下列叙述错误的是
| A.用金属钠可区分乙醇与乙醚 |
| B.用溴水可区分己烷和3--己烯 |
| C.用水可区分苯和溴苯 |
| D.用新制的氢氧化铜悬浊液可区分甲酸甲酯和乙醛 |
下列有机物中能发生消去反应,且生成中存在同分异构体的是
A.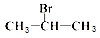 |
B.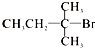 |
C.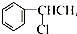 |
D.CH3Cl |
某一兴趣小组准备在实验室中制H2,装置如图所示。可是在实验室中发现酸液体积不足液面无法浸没锌粒,而又无其他酸液可加入,为达到实验目的,则可以从长颈漏斗中加入下列试剂中的①NaN03溶液②酒精③四氯化碳 ④汽油⑤Na2C03溶液⑥KCl溶液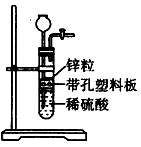
| A.①②③ | B.②④⑤ | C.②③④⑥ | D.②③⑥ |
XeF4在水中发生反应:6XeF4+12H2O=2XeO3+4Xe↑+24HF+3O2↑下列判断中正确的是
| A.XeF4分子具有非常好的热稳定性 |
| B.XeF4分子中Xe的化合价为0价 |
| C.氧化剂和还原剂的物质的量之比为2:3 |
| D.每生成4 molXe转移16 mol电子 |
水钴矿(含CuO、Co2O3、Fe2O3、MgO等)用硫酸法浸出铜和钴,下图是不同还原剂对元素浸出率的影响(硫酸的浓度3 mol•L-1,温度60℃),下列说法正确的是
| A.是否使用还原剂对铜的浸出率影响很大 |
| B.用Na2SO3、NaNO2作还原剂,钴的浸出率 均达98%,但工业上宜选用Na2SO3 |
| C.加入还原剂的主要目的是为了还原Fe3+ |
| D.用Na2SO3作还原剂可使镁元素以单质 形式析出而有较大浸出率 |