配制一定物质的量浓度的NaOH溶液时,造成实验结果偏低的是
| A.样品中含有少量Na2O杂质 |
| B.容量瓶中原来有少量蒸馏水 |
| C.定容时观察液面仰视 |
| D.未冷却至室温直接把NaOH溶液移入容量瓶中 |
已知3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O,则下列说法不正确的是
| A.Cu作还原剂,HNO3作氧化剂 |
| B.HNO3在该反应中只有部分表现出了氧化性 |
| C.每生成22.4L(标准状况)NO有3mol的电子转移 |
| D.如果有8molHNO3被还原,则生成了2molNO |
下列反应中,不是氧化还原反应的是
①H2+Cl2 2HCl ②Na2CO3+2HCl═2NaCl+H2O+CO2↑
2HCl ②Na2CO3+2HCl═2NaCl+H2O+CO2↑
③2H2O 2H2↑+O2↑④CuO+2HNO3═Cu(NO3)2+H2O
2H2↑+O2↑④CuO+2HNO3═Cu(NO3)2+H2O
⑤2HgO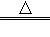 2Hg+O2↑
2Hg+O2↑
| A.②④ | B.①③ | C.①②③ | D.④⑤ |
下列说法正确的是
| A.蒸馏时,通入冷凝管的水从其上口流进,下口流出 |
| B.一束平行光照射CuSO4溶液时,从侧面可看到光亮的通路 |
| C.电解质溶液导电的原因是因为有自由移动的离子 |
| D.将饱和的FeCl3溶液滴入沸腾的NaOH溶液中可制得氢氧化铁胶体 |
配制250 mL、0.10 mol·L-1的NaOH溶液时,下列实验操作会使配得的溶液中NaOH物质的量浓度偏大的是
| A.转移溶液后未洗涤烧杯和玻璃棒就直接定容 |
| B.在容量瓶中进行定容时仰视刻度线 |
| C.在容量瓶中进行定容时俯视刻度线 |
| D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又补足了所缺的水 |
下列离子反应方程式正确的是
| A.硫酸铝与氨水反应:Al3++3OH-=Al(OH)3 ↓ |
| B.碳酸钙溶于醋酸:CaCO3+2H+ =Ca2++H2O+CO2 ↑ |
| C.CO2与水的反应:CO2 + H2O = 2H++ CO32- |
| D.NaHCO3溶液中加入盐酸:H++HCO3-= CO2↑+H2O |