氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,该反应的热化学方程式为 。
(2)298 K时,在固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g) ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为 L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是 :
a.混合气体的密度保持不变;
b.混合气体的颜色不再变化;
c.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.3" mol·mol-1,n(N2O4)="0.6" mol·mol-1,则此时V(正) V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是 。
向2L密闭容器中通入amol 气体 A和bmol气体B,在一定条件下发生反应;
已知:平均反应速率 ;反应2min 时,A的浓度减少了
;反应2min 时,A的浓度减少了 ,B的物质的量减少了
,B的物质的量减少了 mol,有a mol D生成。回答下列问题
mol,有a mol D生成。回答下列问题
(1)反应2min内,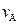 =,
=, ;
;
(2)化学方程式中,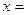 、
、 、
、 、
、 ;
;
(3)反应平衡时,D为2a mol,则B的转化率为;
(4)如果只升高反应温度,其他反应条件不变,平衡时D为 1.5a mol,则该反应的
0;(填“>”、“<”或“=”)
(5)如果其他条件不变,将容器的容积变为1L,进行同样的实验,则与上述反应比较:
①反应速率(填“增大”、“减小”或“不变”),理由是;
②平衡时反应物的转化率(填“增大”、“减小”或“不变”),理由是。
右图所表示在密闭容器中反应:2SO2(g)+O2(g)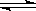 2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是;b ~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处.
2SO3(g)ΔH<0达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a ~b过程中改变的条件可能是;b ~c过程中改变的条件可能是;若增大压强时,反应速度变化情况画在c~d处. 
18.在一定温度、一定体积的密闭容器中,对于N2(g)+3H2(g) 2NH3(g)的反应,达到平衡
2NH3(g)的反应,达到平衡
的标志是。
| A.生成氨的速率与NH3的分解速率相等 | B.断开一个N≡N键的同时有6个N—H键生成 |
| C.N2、H2、NH3百分含量不再变化 | D.总压强不变 |
E.N2、H2、NH3分子数之比为1∶3∶2的状态 F.N2、H2、NH3的浓度相等
G.N2、H2不再起反应 H.v(N2)= v(H2)
v(H2)
I.混合气体的密度不变 J.混合气体的平均摩尔质量不变
已知下列热化学方程式:①H2(g) +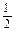 O2(g)=H2O(l);ΔH="-285" kJ·mol-1
O2(g)=H2O(l);ΔH="-285" kJ·mol-1
②H2(g) +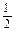 O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1
O2(g)=H2O(g);ΔH="-241.8" kJ·mol-1
③C(s) +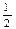 O2(g)=CO(g);ΔH="-110.5" kJ·mol-1
O2(g)=CO(g);ΔH="-110.5" kJ·mol-1
④ C(s) +O2(g)=CO2(g);ΔH="-393.5" kJ·mol-1
回答下列问题:
(1)H2的燃烧热为;C的燃烧热为。
(2)燃烧1gH2生成液态水,放出的热量为。
(3)写出CO燃烧的热化学方程式。
某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去)。已知①图中每个小三角形的三种物质中至少含有一种相同元素,K与L、A与B分别含有相同的元素。②D,J为固体单质,R为气体单质,其余为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性。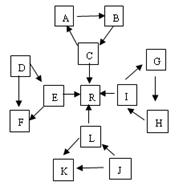
(1) J物质的化学式为,B所形成的晶体
为晶体,工业上要让B转化为C,与B反应的原料是。
(2)标况下,由E生成R 11.2 L时转移的电子数为。
(3)C+J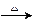 A+L的化学方程式为:。
A+L的化学方程式为:。
I+F→G的离子方程式为: 。
。
(4)常温下,测得一定浓度的G溶液的pH=10,试用离子方程式表示其原因 。
。
(5)J的最简单氢化物可与空气在碱性溶液中形成燃料电池,其负极电极反应式为。