配制溶质质量分数为10%的下列溶液,能达到目的的是( )
| A.称取10.0g氯化钠,放入90mL水中,充分搅拌 |
| B.称取10.0g生石灰,放入90mL水中,充分搅拌 |
| C.量取10.0mL浓盐酸,放入90mL水中,充分搅拌 |
| D.称取10.0g硫酸钡,放入90mL水中,充分搅拌 |
如图是三种固体物质的溶解度曲线,下列说法正确的是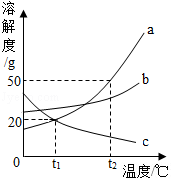
| A.物质c的溶解度随温度的升高而增大 |
| B.物质a的溶解度大于物质c的溶解度 |
| C.t2℃时,60g物质a与100g水充分混合后所得溶液的总质量为160g |
| D.将t1℃b,c两种物质的饱和溶液升温至t2℃,溶液中溶质质量分数不变的是b溶液 |
下图是甲、乙、丙三种固体物质的溶解度曲线。下列叙述错误的是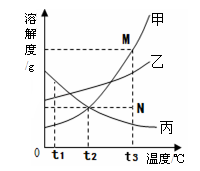
| A.t1℃时,三种物质的溶解度大小顺序为:丙>乙>甲 |
| B.t2℃时,甲、丙两种物质的溶液中溶质的质量分数相等 |
| C.若甲物质中混有少量的乙物质,可用降温结晶的方法提纯甲 |
| D.若要将组成在N点的甲溶液转变为M点的甲溶液,可以采用恒温蒸发溶剂的方法 |
甲、乙两种物质的溶解度曲线如图。t1℃时,在两支试管中分别加入等质量的两种物质,再分别加入等量的蒸馏水,充分振荡后,试管底部均有未溶解的固体。再将两支试管升温到t2℃(不考虑溶剂质量变化)。由t1℃到t2℃的过程中,下列说法正确的是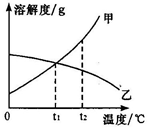
| A.甲溶液中溶质的质量分数减小 |
| B.装有乙物质的试管中剩余的固体增多 |
| C.甲、乙两种物质的溶解度都增大 |
| D.两支试管里剩余的固体质量相同 |
盐场晒盐后得到的卤水中含有MgCl2、KCl和MgSO4等物质,它们的溶解度曲线如下图所示。下列说法正确的是
| A.MgSO4的溶解度始终随温度的升高而减小 |
| B.t1℃时,KCl和MgSO4两溶液所含溶质质量一定相等 |
| C.t2℃时,100gMgCl2的饱和溶液中含有agMgCl2 |
| D.将t1℃时的KCl饱和溶液升温到t2℃,溶液由饱和变为不饱和 |
下表是NaCl、KNO3在不同温度时的溶解度
| 温度/℃ |
10 |
20 |
30 |
40 |
50 |
60 |
|
| 溶解度/g |
NaCl |
35.8 |
36.0 |
36.3 |
36.6 |
37.0 |
37.3 |
| KNO3 |
20.9 |
31.6 |
45.8 |
63.9 |
85.5 |
110 |
|
据此数据,下列有关说法中错误的是
A.在40℃时,100g水中最多可溶解KNO363.9g
B.KNO3和NaCl的溶解度曲线在20℃~40℃温度范围内相交
C.在60℃时,KNO3饱和溶液210g加入10g水后,溶质质量分数为50%
D.在20℃时KNO3和NaCl的混合溶液100g,恒温蒸发,先析出的晶体一定是NaCl