下列离子方程式正确的是
| A.大理石溶于醋酸:CaCO3+2H+= Ca2++CO2↑+H2O |
| B.FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+= 2Fe3++2Cl- |
| C.向澄清石灰水中通入少量CO2:OH-+CO2= HCO3- |
| D.酸性氢氧燃料电池的正极反应:H2-2e-= 2H+ |
下列说法不正确的是
| A.科学家在研究物质微观结构的过程中先后使用了光学显微镜、电子显微镜、扫描隧道显微镜等观测仪器 |
| B.H2O2在过氧化氢酶的催化下,随着温度的升高,分解速率持续加快 |
| C.甲醇、肼、氨等燃料电池的能量转换效率远高于普通燃料燃烧的能量转化效率 |
| D.钠和钾的合金在室温下呈液态,可用于快中子反应堆作热交换剂 |
如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是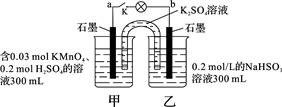
| A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1 |
| B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a |
| C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小 |
| D.乙池中的氧化产物为SO42- |
下列电解质溶液中有关浓度关系不正确的是
| A.浓度均为0.1 mol/L的HF、KF混合溶液中:2c(H+)+c(HF)=2c(OH-)+c(F-) |
| B.0.1 mol/L的Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) |
| C.常温下,pH=5的NaHSO3溶液中,水电离出的c(H+)=1.0×10-9 mol/L |
| D.铵根离子浓度均为0.1 mol/L的 ①NH4Cl、②NH4Al(SO4)2、③NH4HCO3三种溶液的浓度:③>①>② |
相同温度下,体积均为1.5 L的两个恒容容器中发生可逆反应:
X2(g+3Y2(g)  2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
2XY3(g) ΔH=-92.6 kJ·mol-1,实验测得有关数据如下表:
| 容器编号 |
起始时各物质物质的量/mol |
达平衡时体系能量的变化 |
||
| X2 |
Y2 |
XY3 |
||
| ① |
1 |
3 |
0 |
放热46.3 kJ |
| ② |
0.8 |
2.4 |
0.4 |
Q(Q>0) |
下列叙述不正确的是
A.容器①中达到平衡时,Y2的转化率为50%
B.Q="27.78" kJ
C.若容器①体积改为1.0 L.则达平衡时放出的热量大于46.3 kJ
D.容器①、②中反应的平衡常数相等,K=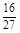
下列离子方程式正确的是
| A.向漂白液溶液中通入少量SO2:3ClO-+SO2+H2O=SO42-+Cl-+2HClO |
B.2-溴丙酸在氢氧化钠热溶液中水解:CH3CHBrCOOH+OH- CH3CH(OH)COOH+Br- CH3CH(OH)COOH+Br- |
| C.向一定量的明矾溶液中逐滴加入Ba(OH)2溶液至沉淀质量最大时:2Al3++3SO42-+3Ba2++6OH-=2Al(OH)3↓+3BaSO4↓ |
| D.硝酸铁稀溶液中加入足量稀氢碘酸:6I-+2NO3-+8 H+=3I2+2NO↑+4H2O |