根据下列实验操作及现象,能得出相应结论的是
| 选项 |
实验操作 |
现象 |
结论 |
| A |
①向溶液中通入CO2, ②继续通入CO2至过量 |
①溶液变浑浊 ②浑浊不消失 |
原溶液一定是NaAlO2溶液 |
| B |
①向溶液中加入KSCN溶液,②滴入一定量盐酸 |
①溶液无明显现象 ②溶液变为血红色 |
原溶液中可能含有Fe2+、NO3- |
| C |
用洁净铂丝蘸取少量溶液进行焰色反应 |
火焰呈黄色 |
原溶液一定是钠盐溶液 |
| D |
向溶液中加入盐酸 |
产生的气体使澄清石灰水变浑浊 |
原溶液中一定含有CO32- |
某有机物具有下列性质,能发生银镜反应;滴入石蕊试液不变色;加入少量碱液并滴入酚酞试液,共煮后红色消失。该有机物可能是( )
| A.甲酸 | B.乙酸甲酯 | C.甲醇 | D.甲酸乙酯 |
二氟甲烷是性能优异的环保产品,它可替代某些会破坏臭氧层的“氟里昂”产品,用作空调、冰箱和冷冻库等中的致冷剂。试判断二氟甲烷的结构简式()
| A.有4种 | B.有3种 | C.有2种 | D.只有1种 |
欲除去混在苯中的少量苯酚,下列实验方法正确的是()
| A.分液 |
| B.加入氢氧化钠溶液后,充分振荡,静置后分液 |
| C.加入过量溴水,过滤 |
| D.加入FeCl3溶液后,过滤 |
下面四种变化中,有一种变化与其他三种变化类型不同的是:( )
A.CH3CH2OH + CH3COOH CH3COOCH2CH3 + H2O
CH3COOCH2CH3 + H2O
CH3CH2OH CH2=CH2↑+H2O
CH2=CH2↑+H2O
C.2CH3CH2OH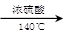 CH3CH2OCH2CH3 + H2O
CH3CH2OCH2CH3 + H2O
D.CH3CH2OH + HBr CH3CH2Br + H2O
CH3CH2Br + H2O
已知A物质的分子结构简式如下: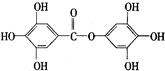 , lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
, lmol A与足量的NaOH溶液混合共热,充分反应后最多消耗NaOH的物质的量为( )
| A.6mol | B.7mol | C.8mo1 | D.9mo1 |