镁合金是重要的民用和航空材料,镁作为一种强还原剂,还用于钛、镀和铀的生产,氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等。
(1)氧化镁的电子式为________。
(2)写出镁与TiCl4在高温条件下制取钛的化学方程式____________________。
(3)从海水中提取金属镁用到的主要化学药品有________________。
(4)某研究小组同学在实验室用卣块制备少量Mg(ClO3)2·6H2O,其流程如下:
已知:I卤块主要成分为Mg Cl2·6H2O,含有MgSO4、FeCl2等杂质。Ⅱ可选用的试剂:H2O2,稀硫酸、KMnO4溶液、MgCl2溶液、MgO。
①加入BaCl2溶液的目的是____________。
②步骤X中需将Fe2+转化为Fe3+,所选的试剂为__________。
③Mg(ClO3)2加入到含有KSCN的FeSO4酸性溶液中立即出现红色,写出相关反应的离子方程式:________________________________________.
(1)下列物质:①石墨 ②三氧化硫 ③液态氯化氢 ④氯气 ⑤熔融的硫酸钾 ⑥食盐晶体 ⑦硫酸溶液 ⑧乙醇 ⑨冰醋酸 ⑩NH3•H2O,其中能够导电的是 ,强电解质是 ,弱电解质是 ,非电解质是 。
(2)H2S溶于水的电离方程式为 。
①向H2S溶液中加入NaOH溶液时,电离平衡向 移动,(填左或右)c(H+) ,c(S2-) 。(填增大或减少或不变)
②向H2S溶液中加入Na2S固体时,电离平衡向 移动, (填左或右)
c(H+) ,c(S2-) 。(填增大或减少或不变)
(1)将等质量的锌粉分别投入10 mL 1 mol/L HCl和10 mL 1 mol/L的CH3COOH溶液中,产生H2的体积分别为V1和V2;①若锌不足量,反应速率快的是_______ ___;②若锌过量,产生H2的量有何关系__________。
(2)将等质量的锌粉分别投入c(H+)均为1 mol/L体积均为10 mL的盐酸和醋酸溶液中,产生H2的体积分别为V1和V2;①若锌不足量,反应速率快的是_______ ___;②若锌过量,产生H2的量有何关系__________。
(10分)请回答下列问题:
(1)等温、等容下,已知2NO+O2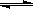 2NO2△H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是(填字母)。
2NO2△H<0,当该反应处于平衡状态时,下列措施中有利于提高NO的平衡转化率的是(填字母)。
| A.升高温度 | B.降低温度 | C.加入O2 | D.减小压强 |
E.加入催化剂 F.增加NO的量
(2)若将l.00 molO2和2.00 mol NO混合充入容积为2 L的密闭容器中,3分钟后反应达到平衡。平衡后混合气体总物质的量为2.55mol,用O2表示的化学反应速率为mol•L-1•min-1。
(3)容积均为2 L的四个密闭容器中均进行着(2)中的反应,某温度下,各物质物质的量(mol)及正逆反应速率关系如下表所示:
| 容器编号 |
n(O2) |
n(NO) |
n (NO2) |
v正与v逆的关系 |
| Ⅰ |
0.20 |
0.10 |
0.20 |
v正=v逆 |
| Ⅱ |
0.20 |
0.40 |
1.00 |
②v正___v逆? |
| Ⅲ |
0.60 |
1.20 |
0.80 |
③v正___v逆? |
①若方程式系数为最简整数比,则该温度下的平衡常数K=
填写表中空格:②③(填>或 <)
( 12分)
(1)二甲醚燃料电池的正极反应式为。电池在放电过程中,负极周围溶液的pH。(填“增大”、“减小” 或“不变”)
(2)以上述电池为电源,通过导线电解池相连。两极为石墨,电解质溶液为1L
0.1mol/LKCl溶液,写出电解总反应的离子方程式为。
(3)室温时,按上述(2)电解一段时间后,取25mL上述电解后溶液,滴加0.2mol/L醋酸得到右图(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。
①若图中的B点pH=7,则滴定终点在区间(填 “AB”、“BC”或“CD”)。
B点溶液中离子浓度大小为。
②D点溶液中C(HAc)C(Ac_ )(填> 、< 或= )。
(16分)图中X、Y、Z为单质,其他为化学物,它们之间存在如下转化关系(部分产物已略去)。其中,A俗称磁性氧化铁;E是不溶于水的酸性氧化物,能与氢氟酸反应。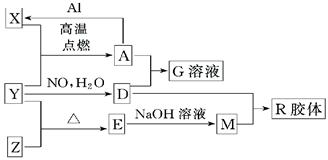
回答下列问题:
⑴组成单质Y的元素在周期表中的位置是;M中存在的化学键类型为;R的化学式是。
⑵一定条件下,Z与H2反应生成ZH4,ZH4的电子式为。
⑶已知A与1molAl反应转化为X时(所有物质均为固体)。放出a KJ热量。写出该反应的热化学方程式:。
⑷写出A和D的稀溶液反应生成G的离子方程式:若转移0.6mol电子,生成的气体在标况下体积为
⑸向含4mol D的稀溶液中,逐渐加入X粉末至过量。假设生成的气体只有一种,请在坐标系中画出n(X2+)随n(X)变化的示意图,并标出n(X2+)的最大值。