一定条件下,分别向容积固定的密闭容器中充入A和足量B,发生反应如下:2A (g) +B (s) 2D (g) △H<0,测得相关数据如下,分析可知下列说法不正确的是
2D (g) △H<0,测得相关数据如下,分析可知下列说法不正确的是
| |
实验I |
实验II |
实验III |
| 反应温度 / ℃ |
800 |
800 |
850 |
| c( A )起始/mol·L-1 |
1 |
2 |
1 |
| c( A)平衡 /mol·L-1 |
0.5 |
1 |
0.85 |
| 放出的热量/kJ |
a |
b |
c |
A.实验III的化学平衡常数K<1
B.实验放出的热量关系为b>2a
C.实验III在30min达到平衡时的速率v (A)为0.005mol·L-1·min-1
D.当容器内气体密度不随时间而变化时上述反应已达平衡
25℃,加水稀释10mLpH=11的氨水,下列判断正确的是
| A.原氨水的浓度=10-3mol /L |
| B.氨水的电离程度增大,溶液中所有离子的浓度均减小 |
C.溶液中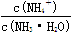 的增大 的增大 |
| D.再加入10mLpH=3的盐酸,混合液pH=7 |
已知镓(31Ga)和溴(35Br)是第四周期的主族元素。下列分析正确的是
| A.与镓同主族且相邻周期的元素,其原子序数为23或49 |
| B.与镓同周期且相邻主族的元素,其原子序数为30或32 |
| C.原子半径:Br>Ga> Cl> Al |
| D.碱性:KOH>Ga(OH)3>Al(OH)3 |
合成尿素的反应2NH3(g) + CO2(g)→CO(NH2)2(s)(尿素) + H2O(l) + Q分两步进行:
①2NH3(g) + CO2(g)→NH4COONH2(s) + Q1,
②NH4COONH2(s)→CO(NH2)2(s) + H2O(l)–Q2。
下列示意图中,能正确表示合成尿素过程中能量变化的是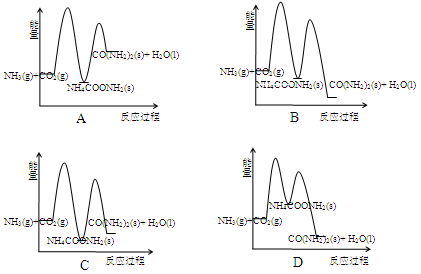
用图中所示的装置进行实验,实验现象与预测不一致的是
| ①中的物质 |
②中的物质 |
预测现象 |
|
| A |
浓氨水 |
FeCl3溶液 |
②中有红褐色沉淀 |
| B |
浓氨水 |
浓盐酸 |
③中有白烟 |
| C |
浓硝酸 |
淀粉KI溶液 |
②中溶液变为蓝色 |
| D |
饱和亚硫酸 |
蓝色石蕊试液 |
②中溶液先变红色又褪色 |
一种新的储氢方法,其原理是NaHCO3+ H2 HCOONa+ H2O。下列叙述正确的是
HCOONa+ H2O。下列叙述正确的是
| A.储氢、释氢的过程均无能量变化 |
| B.NaHCO3、HCOONa均含有离子键和共价键 |
| C.储氢过程中NaHCO3被氧化 |
| D.释氢过程中每消耗0.1molH2O放出2.24L的H2 |