碳和氮的化合物与人类生产、生活密切相关。
(1)在一恒温、恒容密闭容器中发生反应:Ni (s)+4CO(g)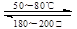 Ni(CO)4(g),ΔH<0。
Ni(CO)4(g),ΔH<0。
利用该反应可以将粗镍转化为纯度达99.9%的高纯镍。下列说法正确的是 (填字母编号)。
| A.增加Ni的量可提高CO的转化率,Ni的转化率降低 |
| B.缩小容器容积,平衡右移,ΔH减小 |
| C.反应达到平衡后,充入CO再次达到平衡时, CO的体积分数降低 |
| D.当4v正[Ni(CO)4]= v正(CO)时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态 |
(2)CO与镍反应会造成含镍催化剂的中毒。为防止镍催化剂中毒,工业上常用SO2将CO氧化,二氧化硫转化为单质硫。
已知:CO (g)+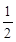 O2(g)=CO2(g) ΔH=-Q1 kJ·mol-1
O2(g)=CO2(g) ΔH=-Q1 kJ·mol-1
S(s)+O2(g)=SO2(g) ΔH=-Q2 kJ·mol-1
则SO2(g)+2CO (g)=S(s)+2CO2(g) ΔH= 。
(3)对于反应:2NO(g)+O2 2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
2NO2(g),向某容器中充入10mol的NO和10mol的O2,在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下随温度变化的曲线(如图)。
①比较P1、P2的大小关系:________________。
②700℃时,在压强为P2时,假设容器为1L,则在该条件平衡常数的数值为____(最简分数形式)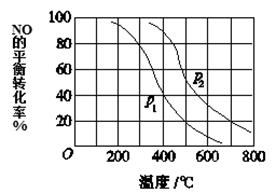
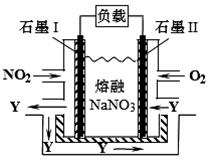
(4)NO2、O2和熔融NaNO3可制作燃料电池,其原理如图所示。该电池在使用过程中石墨I电极上生成氧化物Y,其电极反应式为 。若该燃料电池使用一段时间后,共收集到20mol Y,则理论上需要消耗标准状况下氧气的体积为 L。
(1)用盐酸检验牙膏中有无碳酸钙的反应的离子方程式是___ _①____,往苯酚溶液中加入几滴氯化铁溶液,观察到的现象是____②____。
_①____,往苯酚溶液中加入几滴氯化铁溶液,观察到的现象是____②____。
(2)将火柴燃烧生成的气体通入盛有少量高锰酸钾酸性溶液的试管中,可以观察到的现象是____③___,说明火柴燃 烧过程中有___④____气体(填名称或符号)生成,反应中高锰酸钾是____⑤____(填“氧化剂”、“还原剂”)
烧过程中有___④____气体(填名称或符号)生成,反应中高锰酸钾是____⑤____(填“氧化剂”、“还原剂”)
(3)往盐酸酸化的FeCl2溶液中,加入NaNO2溶液,除了气体之外还能够观察到的现象是___⑥____,反应的离子方程式____⑦___,反应中NaNO2是___⑧___(填“氧化剂”、“还原剂”)。
物质的分离是化学研究中常用的方法,填写下列物质分离时需使用的方法(不必叙述操作细节)。
(1)两种互不相溶的液体的分离①。
(2)固体和液体的分离②。
(3)含固体溶质的溶液中除去部分溶剂③。
(4)胶体中分离出可溶电解质④。
(5)几种沸点相差较大的互溶液体的分离⑤。
海水是一种丰富的资源,工业上从海水中可提取许多种物质,广泛应用于生活、生产、科技等方面。下图是某工厂对海水资源进行综合利用的示意图。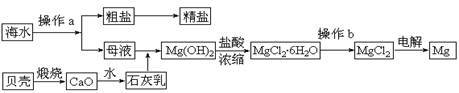
回答下列问题:
(1)流程图中操作a在蒸发结晶后进行(填操作名称)。
(2)工业上从海水中提取的NaCl,可用来制取纯缄,其简要过程如下:向饱和食盐水中
先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①气体A、B是CO2或NH3,则气体A应是(填化学式)。
②滤液D中主要含有NH4Cl、NaHCO3等物质,工业上是向滤液D中通入NH3,并加入细小食盐颗粒,冷却析出不含有NaHCO3的副产品NH4Cl晶体,则通入NH3的作用是 。
(3)镁是一种用途很广的金属材料,目前世界上60%的镁从海水中提取。
①若要验证所得无水MgCl2中不含NaCl,最简单的操作方法是:
。
②操作b是在氛围中进行,若在空气中加热,则会生成Mg(OH)Cl。
(1)在T1℃时,向容积为2L的密闭容器甲中加入1molN2、3 molH2及少量固体催化剂,发生反应N2(g)+3H2(g) 2NH3(g)DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
2NH3(g)DH<0,10min时各物质的浓度不再变化,测得NH3物质的量为0.4mol。
①该反应在0~10min时间内H2的平均反应速率为mol·L-1·min-1,N2的转化率为。
②在T1℃时,若起始时在容器甲中加入0.5molN2、1.5 molH2、1molNH3,则达到平衡时NH3的物质的量为(填选项字母)
A.大于0.4mol B.等于0.4mol C.小于0.4mol
③下图是在T1℃时密闭容器甲中H2的体积分数随时间t的变化曲线,请在该图中补画出该反应在T2℃(T2>T1)时的H2体积分数随时间t的变化曲线。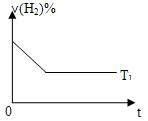
(2)明矾可做净水剂是因为(用离子方程式表示);
向明矾的水溶液中加入饱和的小苏打溶液发生反应的离子方程式为。
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。肼—空气燃料电池放电时:正极的电极反应式是,负极的电极反应式是 。
(3)如图是一个电化学过程示意图。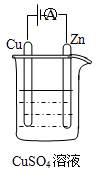
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化
128g,则肼一空气燃料电池理论上消耗标准状况下的空气L。
(假设空气中氧气体积含量为20%)