(12分)某学校研究性学习小组设计实验探究铝等金属的性质:将一置于空气中的铝片投入浓氯化铜溶液中,铝片表面出现一层海绵状暗红色物质,接下来铝片上产生大量气泡,产生的气体,具有可燃性,溶液温度迅速上升。若用同样的铝片投入同浓度的硫酸铜溶液中,在短时间内铝片无明显变化。
(1)铝与氯化铜溶液能迅速反应,而与同浓度的硫酸铜溶液在短时间内不反应的原因可能是 。
A.铝与Cl—反应,铝与SO42—不反应
B.氯化铜溶液酸性比同浓度的硫酸铜溶液酸性强
C.硫酸铜水解生成硫酸使铝钝化
D.氯离子能破坏氧化铝表面薄膜,而硫酸根离子不能
E.生成氯化铝溶于水,而生成硫酸铝不溶于水
(2)放出的气体是 ,请分析开始阶段产生气体的速率不断加快的原因是 。
(3)某同学通过其它的实验操作,也能使铝片与硫酸铜溶液反应加快,他采取的措施可能是 。
A.用砂纸擦去铝片表面的氧化膜后投入硫酸铜溶液中
B.把铝片投入热氢氧化钠溶液中一段时间后,取出洗涤,再投入硫酸铜溶液中
C.向硫酸铜溶液中滴加氢氧化钠溶液,再投入铝片
D.向硫酸铜溶液中加入氯化钠固体,再投入铝片
(4)除去氧化铝的铝片与镁片为电极,在X电解质溶液中构成原电池,列表如下:
| 选项 |
铝电极 |
电解质 |
负极反应 |
正极反应 |
| A |
负极 |
NaOH |
2Al-6e—+8OH—=2AlO2—+4H2O |
6H2O+6e—=6OH—+3H2↑ |
| B |
负极 |
稀盐酸 |
2Al-6e—=2Al3+ |
6H++6e—=3H2↑ |
| C |
正极 |
浓硝酸 |
Mg+2e—=Mg2+ |
2NO3—+4H+-4e—=2NO2↑+2H2O |
其中正确的是 (填序号),由此推知,金属作电极不仅与本身性质相关,而且与 有关。
(6分)实验室有下列实验仪器
在过滤操作中除了铁架台外还需要用到的实验仪器是、、。
现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:①2Mg+O2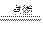 2MgO;②3Mg+N2
2MgO;②3Mg+N2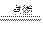 Mg3N2;
Mg3N2;
③2Mg+CO2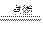 2MgO+C④Mg+H2O
2MgO+C④Mg+H2O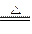 MgO+H2↑⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
MgO+H2↑⑤Mg3N2 +6H2O ===3Mg(OH)2+2NH3↑
可供选择的装置和药品如下页图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题;
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别为(可不填满)
| 装置 |
目的 |
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)______ ;
;
(3)通气后,应先点燃处的酒精灯,再点燃处的酒精灯;如果同时点燃A、
F装置的酒精灯,对实验结果有何影响?__________;
(4)请设计一个实验,验证产物是Mg3N2,写出操作步骤、现象和结论:_____________。
为防止碘缺乏病,通常在食盐中加入KIO3。
(1)用淀粉碘化钾溶液和稀硫酸可定性检验出食盐中的IO3-,表示该反应的离子方程
式是________________________________________,
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液
将I2还原,又可以回收四氯化碳。Na2SO3稀溶液与I2反应的离子方程式是。
(3)已知:I2+2S2O32-=2I-+S4O62-。
某课外活动小组为测定混有MgCl2的食用加碘盐中所含MgCl2、KIO3的含量,按下图所示实验步骤进行实验。
请回答下列问题:
①写出B和C的化学式:B,C。
②滴定时,判断滴定达到终点的现象是。
③KIO3的质量分数是(列出计算式)。
④使所测MgCl2的质量分数可能偏高的操作是(填写字母)
A过滤后未洗涤所得沉淀,直接烘干灼烧
B在敞口容器中用托盘天平称量样品时,操作时间过长
C沉淀灼烧不彻底
晶体具有规则的几何外形,晶体中最基本的重复单元称之为晶胞。NaCl晶体的晶胞如右图所示。 随着科学技术的发展,测定阿伏加德罗常数的手段越来越多,测定精确度也越来越高。现有一简单可行的测定方法,具体步骤如下:①将固体食盐研细,干燥后,准确称取m gNaCl固体并转移到定容仪器A中。②用滴定管向仪器A中加苯,并不断振荡,继续加苯至A仪器的刻度 线,计算出NaCl固体的体积为VmL。回答下列问题:
线,计算出NaCl固体的体积为VmL。回答下列问题:
⑴步骤①中A仪器最好用__________________(填仪器名称)。
⑵能否用胶头滴管代替步骤②中的滴定管______,其原因是____________。
⑶能否用水代替苯_______,其原因是_________________________________。
⑷经X射线衍射测得NaCl晶胞中最邻近的Na+ 和Cl- 平均距离为a cm,则利用上述
方法测得的阿伏加德罗常数的表达式为NA=_______________________。
选择下列实验方法分离物质,将分离方法的序号填在横线上。
| A.萃取分液法 | B.加热分解 | C.结晶法 | D.分液法 E.蒸馏法 F.过滤法 |
⑴从碘的水溶液中提取碘:;
⑵从硝酸钾和氯化钠的混合溶液中获得硝酸钾:;
⑶分离水和油的混合物:;
⑷分离CCl4(沸点:76.75℃)和甲苯(沸点:110.6℃)的混合:。