(12分)下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,②是工业上重要的反应之一。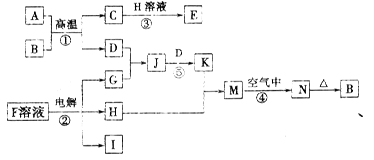
请回答下列问题:
(1)H中含有的化学键类型是_________________。
(2)上述框图所示的反应中,既属于化合反应,又属于氧化还原反应的反应共有______个;反应③的离子方程式_____________。
(3)25℃时,以Pt为电极电解含有少量酚酞的F的饱和溶液,若在溶液变红的一极收集到0.2 g气体,则此时溶液的pH是_______(假设溶液的体积为2 L且不考虑电解后溶液体积的变化)。
(4)J溶液显_______(填“酸”、“碱”或“中”)性,原因是_________________________。(用离子方程式表示)
(1)根据化学方程式,写出对应的离子方程式:
①AgNO3+KCl=AgCl↓+KNO3
②CuO+H2SO4=CuSO4+H2O
(2)写出一个能实现下列离子反应的化学方程式:
①Fe+Cu2+=Fe2++Cu
②CO32-+2H+=CO2↑+H2O
(1)标准状况下,5.6LSO2的质量为克,共含有个原子。
(2)质量相同的 HCl、NH3、CO2、O2四种气体中,含有分子数目最少的是 (填分子式,下同),在相同温度和相同压强条件下,体积最大的是 。
(3)用托盘天平称取5.0 g CuSO4·5H2O晶体,溶于水配成100mL溶液,其物质的量浓度为 。
一定量的氢气在氯气中燃烧,所得混合物用100ml3.00mol/L的NaOH溶液恰好完全吸收,测得溶液中含有NaClO的物质的量为0.05mol。
(1)所得溶液中Cl-的物质的量为mol。
(2)参加反应的氢气在标准状况下的体积是L。(写出计算过程,下同)
(3)所用氯气和参加反应的氢气的物质的量之比为。
有一瓶澄清的溶液,其中可能含H+、NH4+、K+、Cu2+、Fe3+、CO32-、I-中的一种或几种,取该溶液进行如下实验:
①用pH试纸检验,表明溶液呈强酸性
②取部分溶液,加入数滴新制的氯水及少量的CCl4,振荡后CCl4层显紫色
③另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
④将③得到的碱性溶液加热,有气体放出,该气体能使湿润的红色石蕊试纸变蓝。
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的有,肯定不存在的离子有。
(2)不能确定是否存在的离子有_______。证明它(们)是否存在的实验方法是。
(3)写出步骤②涉及的离子方程式,并用单线桥标出电子转移的方向和数目。
(4)写出步骤④涉及的离子方程式。
丰富多彩的材料使我们的生活更美好。
(1)生产硅酸盐水泥和普通玻璃都用到的主要原料是(填名称)。
(2)生活中有大量的铝制品。家用铝锅不能经常用热碱水洗涤去污,原因是(用离子方程式表示)。
(3)鉴别真假羊毛衫的方法是先取样,再_____ _____。