下列化学反应在冶金工业中没有得到广泛应用的是
A.MgCl2(熔融)  Mg+Cl2↑ Mg+Cl2↑ |
B.Al2O3+3C 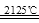 2Al+3CO↑ 2Al+3CO↑ |
C.Fe2O3 +3CO  2Fe +3CO2↑ 2Fe +3CO2↑ |
D.2Ag2O 4Ag+O2↑ 4Ag+O2↑ |
生活中遇到的某些问题,常常涉及到化学知识,下列各项叙述正确的是
| A.“加碘盐”、“高钙牛奶”、“富硒营养品”等食用品中的碘、钙、硒是指单质 |
| B.为了防止中秋月饼等富脂食品氧化变质,延长食品保质期,在包装袋中常放入生石灰 |
| C.医疗上进行胃部造影前,患者服用的“钡餐”是BaCO3等不溶于水的物质 |
| D.“热的纯碱溶液去油污”,“农村施肥时草木灰不能与铵态氮肥混用”,都是利用了盐类水解的原理 |
在一定温度下,将气体X和气体Y各0.16mol充入10 L恒容密闭容器中,发生反应:
X(g)+Y(g) 2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
2Z(g) △H<0。一段时间后达到平衡,反应过程中测定的数据如下表:
| t/min |
2 |
4 |
7 |
9 |
| n(Y)/mol |
0.12 |
0.11 |
0.10 |
0.10 |
下列说法正确的是
A.反应前2 min的平均速率ν(Z) = 2.0×10-3mol·L-1·min-1
B.其他条件不变,降低温度,反应达到新平衡前ν(逆)>ν(正)
C.保持其他条件不变,起始时向容器中充入0.32 mol气体X和0.32 mol 气体Y,到达平衡时,n(Z)<0.24 mol
D.其他条件不变,向平衡体系中再充入0.16mol气体X,与原平衡相比,达到新平衡时,气体Y的转化率增大,X的体积分数增大
25 ℃时,下列溶液中微粒的物质的量浓度关系正确的是
| A.Na2CO3溶液:c(OH-)-c(H+)=c(HCO3-)+ 2c(H2CO3) |
| B.浓度均为0.1 mol·L-1的CH3COOH和CH3COONa混合液(pH<7):c(CH3COOH)>c(CH3COO-)>c (Na+)>c(H+)>c(OH-) |
| C.浓度均为0.1 mol·L-1的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+ c(H2CO3) |
| D.向0.1 mol/L NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向碳酸钠溶液中滴加1滴酚酞,然后逐滴稀盐酸 |
红色褪去,有气体产生 |
酸性:盐酸>碳酸 |
| B |
在酒精灯上加热铝箔 |
铝箔熔化但不滴落 |
熔点:氧化铝>铝 |
| C |
常温下,向浓硝酸中投入铝片 |
铝片不溶解 |
常温下,铝不与浓硫酸反应 |
| D |
向某溶液中先滴加少量氯水再滴加KSCN溶液 |
溶液变成血红色 |
溶液中含有Fe2+ |
化合物C是制备香草醛的一种中间体,其结构简式如图,下列说法正确的是
| A.每个C分子中含有1个手性碳原子 |
| B.可以用酸性KMnO4溶液检验中是否含有碳碳双键 |
| C.1molC分子最多可与4molH2发生加成反应 |
| D.C可发生加成反应、取代反应、氧化反应、消去反应 |