氯化铁是常见的水处理剂,无水FeCl3的熔点为555 K、沸点为588 K。工业上制备无水FeCl3的一种工艺如下: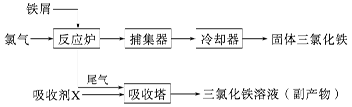
(1)取0.5 mL三氯化铁溶液滴入50 mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为________________________________。
(2)已知六水合氯化铁在水中的溶解度如下:
| 温度/℃ |
0 |
10 |
20 |
30 |
50 |
80 |
100 |
| 溶解度 (g/100 g H2O) |
74.4 |
81.9 |
91.8 |
106.8 |
315.1 |
525.8 |
535.7 |
从FeCl3溶液中获得FeCl3·6H2O的方法是__________________________。
(3)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+ 开始沉淀;当溶液pH为4时,c(Fe3+)=__________mol·L-1 ( 已知:Ksp[Fe(OH)3]=1.1×10-36 ) 。
(4)吸收剂X是__________________;吸收塔中吸收剂X的作用是_______________________。
(5)FeCl3的质量分数通常可用碘量法测定:称取m g无水氯化铁样品,溶于稀盐酸,再转移到100 mL容量瓶中,用蒸馏水定容; 取出10.00 mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用c mol·L-1 Na2S2O3溶液滴定(I2+2S2O32-=2I-+S4O62-),共用去V mL。则样品中氯化铁的质量分数为____。
A、B、C、D、E五种短周期元素,其原子序数依次增大,而原子半径按A、C、B、E、D顺序依次增大。A、D同主族;B、D、E三种元素原子的最外层电子数之和为10;E的单质可做半导体材料;C与E两元素形成的化合物可与A、C、D形成的化合物Y发生反应;B元素的气态氢化物与其最高价氧化物的水化物可以发生反应生成化合物M。1molM中含有42mol电子。回答下列问题:
(1)E元素在周期表中的位置;化合物M中含有的化学键类型有
(2)比较B、C、E形成的气态氢化物的稳定性由强到弱的顺序是: ___________________ _ _______________(用化学式表示);写出C与A形成的18e-化合物的电子式;
(3)用电子式表示A2C的形成过程:。
(4)写出C与E两元素形成的化合物与Y溶液反应的离子方程式:__________________________;写出题中生成M的化学方程式。
右图是中学化学中常见物质之间的一些反应关系,其中部分产物未写出。常温下酸式盐X是固体,B和G是液体,其余均为气体,F是红棕色气体。根据下图关系推断:
(1)化学式:X ___________。
(2) 写出C—→E的化学反应方程式______________________________________。
(3) 请写出F与B反应生成G的化学方程式:____________________,该反应过程中氧化产物和还原产物的物质的量之比为__________________。
下表是元素周期表的一部分,请回答有关问题:
IAⅡAⅢA ⅣA VAⅥA ⅦA 0
1 a b
2 c d e f g
3 h i j k l
4 m n
(1)a元素与d元素形成的化合物的电子式:_____________________;
(2)用电子式表示mn化合物的形成过程_________________________;
(3)属于稀有气体的是__________(填元素符号,下同);
(4)将等物质的量的k元素的单质通入FeBr2溶液中,发生反应的离子方程式是:___________________________,该反应的氧化剂是:__ _____________(写物质名称);
(5)表中能形成两性氢氧化物的元素是_______,写出其氢氧化物与h的氢氧化物的水溶液反应的离子方程式____________________________________________;
(1)电解精炼铜阳极的主要反应是,还会发生的反应有(任写一个)。
(2)电解精炼铜的阳极泥中含有铜和金、银等贵重金属及稀有金属。提炼阳极泥的方法有多种,湿法提炼是其中重要的一种,其主要生产流程如下: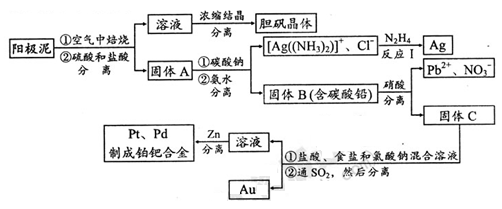
请回答下列问题:
①各步生产流程中都涉及了同一种分离方法,实验室中不能用这种方法来分离液态胶体中分散质与分散剂的原因是。
②用硝酸处理固体B中碳酸铅的离子方程式是。
③反应I中肼(N2H4)的作用是。
④固体C用盐酸、食盐和氯酸钠混合溶液处理后得到H2PtCl6、AuCl3、PdCl2。反应中每消耗lmol氧化剂要转移mol e-;在AuCl3溶液中通入SO2生成单质金,当生成19.7gAu时,25℃和101kPa下反应消耗L SO2(此条件下的气体摩尔体积为24.5L/mol)。
苯乙酮(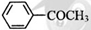 )是最简单的芳香酮,它是制备药物、调味剂、有机高聚物和催泪瓦斯等的中间体。合成苯乙酮有如下两条路线:
)是最简单的芳香酮,它是制备药物、调味剂、有机高聚物和催泪瓦斯等的中间体。合成苯乙酮有如下两条路线: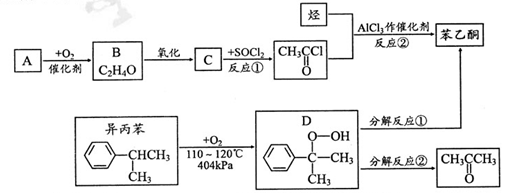
(1)A的结构简式为;苯乙酮分子中官能团的名称是。
(2)反应①的反应类型是;反应②的化学方程式为。
(3)D很不稳定.可以发生合成路线中的两种分解反应生成另一种产物。写出D分解后的另一种物质的结构简式:分解反应①;分解反应②。
(4)写出同时符合下列条件的苯乙酮的同分异构体的结构简式。
①属芳香族化合物;②能发生银镜反应;③苯环上一取代物有4种。
(5)异丙苯具有的化学性质有。(填编号)
a.能催化加氢
b. 能使酸性高锰酸钾溶液褪色
c.在催化剂作用下与液溴发生取代反应
d. 能与乙醇反应生成芳香醚
e.能与饱和溴水发生取代反应