[化学──选修3:物质结构与性质](15分)
稀土元素是指元素周期表中原子序数为57 到71 的15种镧系元素,以及与镧系元素化学性质相似的钪(Sc)和钇(Y)共17 种元素。稀土有“工业维生素”的美称,如今已成为极其重要的战略资源。
(1)钪(Sc)为21号元素,其基态原子M能层电子数为 。镝(Dy)的基态原电子排布式为[Xe]4f106s2,一个基态镝原子所含的未成对电子数为 。
(2)稀土元素最常见的化合价为+3价,但也有少数还有+4价。请根据下表中的电离能数据判断表中最有可能有+4价的元素是 。
几种稀土元素的电离能(单位:kJ·mol-1)
| 元素 |
I1 |
I2 |
I3 |
I1+I2+I3 |
I4 |
| Sc(钪) |
633 |
1235 |
2389 |
4257 |
7019 |
| Y(钇) |
616 |
1181 |
1980 |
3777 |
5963 |
| La(镧) |
538 |
1067 |
1850 |
3455 |
4819 |
| Ce(铈) |
527 |
1047 |
1949 |
3523 |
3547 |
(3)离子化合物 Na3[Sc(OH)6]中,存在的作用力除离子键外还有 。
(4)Sm(钐)的单质与1,2-二碘乙烷可发生如下反应:Sm+ICH2CH2I→SmI2+CH2=CH2。ICH2CH2I中碳原子杂化轨道类型为 ,1mol CH2=CH2中含有的σ键数目为 。常温下1,2-二碘乙烷为液体而乙烷为气体,其主要原因是 。
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中Pr(镨)原子位于面心和顶点。则PrO2(二氧化镨)的晶胞中有 个氧原子。
(6)Ce(铈)单质为面心立方晶体,其胞参数为a=516pm。晶胞中Ce(铈)原子的配位数为 ,列式表示Ce(铈)单质的密度: g·cm-3(不必计算出结果)
有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如下实验,通过测量反应前后C、D装置质量的变化,测定该混合物中各组分的质量分数。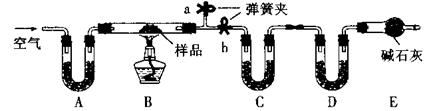
⑴实验时,B中发生反应的化学方程式为 , 。
⑵装置C、D中盛放的试剂分别为:C ,D (供选试剂为:浓硫酸、无水CaCl2、碱石灰)。
⑶E装置中的仪器名称是 ,它在该实验中的主要作用是 。
⑷若将A装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量将 (填“偏高”、“偏低”或“无影响”)。
⑸反应前,在B装置中通入空气可减少实验误差,操作方法是 。
⑹若样品的质量为mg,反应后C、D的质量差分别为m1g、m2g,则该混合物中Na2CO3·10H2O的质量分数为: 。
棕榈科植物槟榔的干燥成熟种子可提取多种有机物,其中之一是异四氢烟酸,它具有镇痛和麻醉作用,异四氢烟酸也可通过实验室合成,其中一种合成路线如图所示:
回答下列问题:
(1)上述转化中的①、③、③、④属于取代反应的是______________(选填序号)。
(2)有机物Ⅳ中含有多种官能团,试写出两种官能团的名称_____________。
(3)有机物Ⅲ在乙醇钠作用下生成的另一种有机物是_____________。
(4)有机物Ⅷ(异四氢烟酸)可以通过加聚反应生成高分子化合物,写出该反应的
化学方程式:_____________________________________。
(5)X是有机物Ⅷ的一种同分异构体,且符合下列转化关系和条件:
写出符合此转化关系和条件的X的结构简式________________________。
已知A、B、C、D、E五种元素的核电荷数依次增大,除E为第四周期元素外,其余都是短周期元素,其中A、B、C是同一周期的非金属元素,A元素最外层电子数是内层电子数的2倍,B元素基态原子的最外层有3个未成对电子,化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构,E元素的+3价离子的3d能级为半充满状态。(答题时用ABCDE对应的元素符号表示)
(1)A的氢化物A2H2分子的空间构型为__________,其中心原子采取的杂化形式为___________,分子中含有___________个 键,__________π键。
键,__________π键。
(2)写出化合物DC的电子式_______,E原子的核外电子排布式________。
(3)由E元素形成的金属的晶胞结构如右图,则该晶胞中含有金属原子的数目为_______________。
(4)化合物E(CO)5常温下为液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此判断E(CO)5晶体属于__________(填晶体类型)。
如何降低大 气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。为减小和消除CO2对环境的影响,一方面世界各国都在限制其排放量,另一方面科学家加强了对CO2创新利用的研究。
(1)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验:某温度下,在容积为2L的密闭容器中,充入1molCO2和3.25molH2在一定条件下发生反应,测得CO2、CH3OH(g)和H2O(g)的物质的量(n)随时间变化如右图所示:
①从反应开始到平衡,氢气的平均反应速率v(H2)=__________________________.
②下列措施中一定不能使CO2的转化率增大的是________________。
| A.在原容器中再充入1molCO2 | B.在原容器中再充入1molH2 |
| C.在原容器中充入1mol氦气 | D.使用更有效的催化剂 |
E.缩小容器的容积 F.将水蒸气 从体系中分离
从体系中分离
(2)常温常压下,饱和CO2水溶液的pH=5.6,c(H2CO3)=1.5×10-5mol/L。若忽略水的电离及H2CO3的第二级电离,则H2CO3
 +H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
+H+的电离平衡常数K=____________。(已知:10-5.6=2.5×10-6)。
(3)标准状况下,将4.48LCO2通入200mL1.5mol/L的NaOH溶液,所得溶液中离子浓度由大到小的顺序为_____________。
(4)如图是甲醇燃料电池(电解质溶液为KOH溶液)的
结构示意图,则a处通入的是_________(填“甲醇”或
“氧气”),其电极上发生的电极反应式为_____________。
(5)已知,常温下Ksp(AgCl)=2.0×10-10,Ksp(AgBr)=5.4×10-13. 向BaCl2溶液中加入AgNO3和KCl,当两种沉淀共存时,溶液中c(Br-)和c(Cl-)的比值为___________。
下图为一些物质间的相互转变关系,反应①在工业上可用来生产化合物C,反应⑤在工业上可生产化合物J(Na2FeO4),反应①、②、④和⑤均是在水溶液中进行的反应.常温下,D、E、G均是气体,B是无色液体;F的水溶液可作为杀菌消毒剂;H是一种铁矿石的主要成分,它由两种元素组成,且其中铁元素的质量分数为70%。
请回答下列问题:
(1)工业上利用反应①生产化合物C,得到化合物C的电极名称是______________。
(2)化合物F中阴离子的电子式为_______________。
(3)反应②的化学方程式为____________________。
(4)反应⑤的离子方程式为_________ __________________。
__________________。
(5)高铁酸钠(Na2FeO4)既能杀菌消毒又是一种“绿色环保高效”的净水剂,其原因为:
①_______________________________________________________。
②_______________________________________________________。